Цели на урока:
- разкажете на учениците за молекулите и атомите и ги научете да ги различават.
Цели на урока:
Образователни: изучавайте нов материал по темата „Молекули и атоми“;
Развитие: насърчаване на развитието на мисленето и когнитивните умения; овладяване на методи за синтез и анализ;
Образователни: насърчаване на положителна мотивация за учене.
Ключови термини:
Молекула– електрически неутрална частица, която се състои от два или повече атома, свързани с ковалентни връзки; най-малката частица от веществото, която има неговите свойства.
атом– най-малката химически неделима част от даден елемент, която е носител на свойствата му; се състои от електрони и атомно ядро. Различен брой различни атоми, свързани чрез междуатомни връзки, образуват молекули.
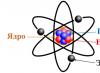
Атомно ядро– централната част на атома, в която е съсредоточена повече от 99,9% от масата му.
3. Защо са частиците, които изграждат вещество?
4.Как да обясним сушенето на дрехите след пране?
5. Защо твърдите вещества, направени от частици, изглеждат твърди?
Молекули.
2.Какви са имената на частиците, които изграждат молекулите?
3. Опишете експеримент, който може да се използва за определяне на размера на молекула.
4. Различават ли се молекулите на едно вещество в различните си агрегатни състояния?
5.Какво е атом и от какво се състои
Домашна работа.
Опитайте експеримент у дома, за да измерите размера на молекулата на всяко вещество.
Интересно е да се знае това.
Концепцията за атома като най-малката неделима част от материята е формулирана за първи път от древните индийски и древногръцките философи. През 17-ти и 18-ти век химиците са успели експериментално да потвърдят тази идея, показвайки, че някои вещества не могат да бъдат допълнително разградени на техните съставни елементи чрез химични методи. Въпреки това, в края на 19-ти и началото на 20-ти век, физиците откриха субатомните частици и съставната структура на атома и стана ясно, че атомът не е наистина „неделим“.
На международния конгрес на химиците в Карлсруе (Германия) през 1860 г. са приети дефиниции на понятията молекула и атом. Атомът е най-малката частица от химичен елемент, която е част от прости и сложни вещества.
Физиката на атомите и молекулите е клон на физиката, който изучава вътрешната структура и физичните свойства на атомите, молекулите и техните по-сложни асоциации (клъстери), както и физическите явления по време на нискоенергийни елементарни актове на взаимодействие между обекти и елементарни частици.
При изучаването на физиката на атомите и молекулите основните са такива експериментални методи като спектроскопия и масова спектрометрия с всичките им разновидности, някои видове хроматография, резонансни методи и микроскопия, теоретични методи на квантовата механика, статистическа физика и термодинамика. Физиката на атомите и молекулите е тясно свързана с молекулярната физика, която изучава (колективните) физични свойства на телата в различни състояния на агрегиране въз основа на отчитането на тяхната микроскопична структура, както и с някои клонове на химията.
Нека направим кратка екскурзия в историята на развитието на атомно-молекулярната теория:
Библиография
1.Урок по темата „Молекули и атоми” от С.В. Громов, И.А. Родина, учители по физика.
2. Урок по темата „Структура на материята“ Фонин Иля Александрович, Камзеева Елена Евгениевна, учител по физика, Общинска образователна институция Гимназия № 8, Казан.
3.G. Остър. Физика. Проблемна книга. Любим водач - М.: Росман, 1998.
4. Меяни А. Голяма книга с експерименти за ученици. М.: „Росмен“. 2004 г
5. Глобална физика „Атоми и молекули“.
Редактирано и изпратено от Борисенко I.N.
Работихте върху урока:
Громов С.В.
Фонин И.А.
Много често можете да чуете мнението, че атомът, като неразделна част от молекула, има същите свойства и има подобна структура. Тази позиция има само частично право на съществуване, тъй като частиците имат общи и отличителни черти. Като начало е достатъчно да разгледаме свойствата на два обекта и да направим допълнителни заключения въз основа на тях.
Атомът може да се разглежда като елементарна частица от еднородно вещество. Такова вещество по дефиниция се състои само от един химичен елемент (C, N, O и други от периодичната таблица). Най-малката част от такива елементи, която може да бъде носител на техните свойства, се нарича атом. Според най-новите съвременни концепции атомът се състои от три компонента: протони, неутрони и електрони.

Първите две субчастици заедно съставят основно ядро, който има положителен заряд. Електроните, движещи се около ядрото, въвеждат компенсационен заряд с обратен знак. Така се прави първото заключение, че повечето атоми са електрически неутрални. Що се отнася до останалата част, поради различни физични и химични процеси, атомите могат или да прикрепят, или да отделят електрони, което води до появата на заряд. Атомът има маса и размер (определени от размера на ядрото) и определя химичните свойства на веществото.
Молекула
Молекулата е минимална структурна единица на материята. Такова вещество може да се състои от няколко химични елемента. Въпреки това едноатомно вещество на един химичен елемент - инертният газ аргон - също може да се счита за молекула. Подобно на атомите, той е електрически неутрален. Възможно е да се йонизира молекула, но е много по-трудно: атомите вътре в молекулата са свързани помежду си чрез ковалентна или йонна връзка. Следователно става много по-трудно да се добави или отнеме електрон. Повечето молекули имат сложна архитектурна структура, където всеки атом заема предварително определеното му място.

Атом и молекула: общи свойства
Структура. И двете частици са структурни единици на материята. В този случай атомът означава един специфичен елемент, докато молекулата вече включва няколко химически свързани атома, но структурата (положително ядро с отрицателни електрони) остава същата.
Електрическа неутралност. При липса на външни фактори - взаимодействие с друго химично вещество, насочено електрическо поле и други стимули - атомите и молекулите нямат заряд.
Заместване. Атомът може да действа като молекула в един случай - при работа с инертни газове. Едноатомният живак също може да се счита за молекула.
Наличие на маса. И двете частици имат своя собствена различна маса. В случай на атом масата зависи от химичния елемент и се определя от теглото на ядрото (протонът е почти 1500 пъти по-тежък от електрона, така че теглото на отрицателна частица често не се взема предвид). Масата на една молекула се определя въз основа на нейната химична формула - елементите, които изграждат нейния състав.
Атом и молекула: отлични свойства
Неделимост. Атомът е най-малкият елемент, от който не може да се изолира още по-малка частица. (Получаването на йон засяга само заряда, а не теглото). Молекулата от своя страна може да бъде разделена на по-малки молекули или може да бъде разделена на атоми. Процесът на разлагане се постига лесно с помощта на химически катализатори. Понякога е достатъчно просто нагряване на веществото.
Свободно съществуване. Молекулата може да съществува свободно в природата. Атомът съществува в свободна форма само в два случая:
- Като моноатомен живак или инертен газ.
- В космически условия всеки химичен елемент може да съществува като отделни атоми.
В други случаи атомът винаги е част от молекулата.
Образуване на заряд. Взаимодействието между ядрото и електрона в атома може лесно да се преодолее дори от най-малкото електрическо поле. По този начин е лесно да се получи положителен или отрицателен йон от атом. Наличието на химични връзки между атомите в една молекула изисква прилагането на много по-голямо електрическо поле или взаимодействие с друго химически активно вещество.
Съдържанието на статията
СТРУКТУРА НА МОЛЕКУЛАТА(молекулярна структура), относителното разположение на атомите в молекулите. По време на химичните реакции атомите в молекулите на реагентите се пренареждат и се образуват нови съединения. Ето защо един от основните химични проблеми е да се изясни разположението на атомите в първоначалните съединения и естеството на промените при образуването на други съединения от тях.
Първите идеи за структурата на молекулите се основават на анализ на химичното поведение на дадено вещество. Тези идеи станаха по-сложни с натрупването на знания за химичните свойства на веществата. Прилагането на основните закони на химията направи възможно определянето на броя и вида на атомите, които изграждат молекулата на дадено съединение; тази информация се съдържа в химичната формула. С течение на времето химиците осъзнаха, че една химична формула не е достатъчна, за да характеризира точно една молекула, тъй като има изомерни молекули, които имат еднакви химични формули, но различни свойства. Този факт кара учените да смятат, че атомите в една молекула трябва да имат определена топология, стабилизирана от връзките между тях. Тази идея е изразена за първи път през 1858 г. от немския химик Ф. Кекуле. Според неговите идеи една молекула може да бъде изобразена с помощта на структурна формула, която показва не само самите атоми, но и връзките между тях. Междуатомните връзки също трябва да съответстват на пространственото разположение на атомите. Етапите на развитие на идеите за структурата на молекулата на метана са показани на фиг. 1. Структурата отговаря на съвременните данни Ж: молекулата има формата на правилен тетраедър, с въглероден атом в центъра и водородни атоми във върховете.
Подобни изследвания обаче не казват нищо за размера на молекулите. Тази информация стана достъпна едва с разработването на подходящи физични методи. Най-важното от тях се оказа рентгеновата дифракция. От моделите на разсейване на рентгенови лъчи върху кристалите стана възможно да се определи точната позиция на атомите в кристала, а за молекулярните кристали беше възможно да се локализират атоми в отделна молекула. Други методи включват дифракция на електрони, докато преминават през газове или пари и анализ на ротационните спектри на молекулите.
Цялата тази информация дава само обща представа за структурата на молекулата. Природата на химичните връзки ни позволява да изучаваме съвременната квантова теория. И въпреки че молекулярната структура все още не може да бъде изчислена с достатъчно висока точност, всички известни данни за химичните връзки могат да бъдат обяснени. Дори е предсказано съществуването на нови видове химични връзки.
Проста ковалентна връзка.
Водородната молекула Н2 се състои от два еднакви атома. Според физическите измервания дължината на връзката - разстоянието между ядрата на водородните атоми (протони) - е 0,70 Å (1 Å = 10 -8 cm), което съответства на радиуса на водородния атом в основно състояние, т.е. в състояние на минимална енергия. Образуването на връзки между атомите може да се обясни само при предположението, че техните електрони са локализирани главно между ядрата, образувайки облак от отрицателно заредени свързващи частици и държащи заедно положително заредени протони.
Нека разгледаме два водородни атома в основно състояние, т.е. състояние, в което техните електрони са при 1 с-орбитали. Всеки от тези електрони може да се разглежда като вълна, а орбиталата като стояща вълна. Когато атомите се приближат един към друг, орбиталите започват да се припокриват (фиг. 2) и, както при обикновените вълни, възниква интерференция - наслагването на вълни (вълнови функции) в областта на припокриване. Ако знаците на вълновите функции са противоположни, тогава по време на интерференция вълните се унищожават взаимно (деструктивна интерференция), а ако са еднакви, тогава те се сумират (конструктивна интерференция). Когато водородните атоми се съберат, са възможни два резултата в зависимост от това дали вълновите функции са във фаза (фиг. 2, А) или в противофаза (фиг. 2, b). В първия случай ще възникне конструктивна интерференция, във втория - деструктивна интерференция и ще се появят две молекулни орбитали; един от тях се характеризира с висока плътност в областта между ядрата (фиг. 2, V), за другата – ниска (фиг. 2, Ж) всъщност е възел с нулева амплитуда, разделяща ядрата.
Така, когато водородните атоми се доближат и взаимодействат 1 с-орбиталите образуват две молекулни орбитали, като два електрона трябва да запълнят една от тях. Електроните в атомите винаги се стремят да заемат най-стабилното положение - това, в което тяхната енергия е минимална. За орбиталата, показана на фиг. 2, V, има висока плътност в областта между ядрата и всеки електрон, който заема тази орбитала, през повечето време ще бъде разположен близо до положително заредени ядра, т.е. неговата потенциална енергия ще бъде малка. Напротив, орбиталата, показана на фиг. 2, Ж, максималната плътност възниква в областите, разположени отляво и отдясно на ядрата, и енергията на електроните, разположени в тази орбитала, ще бъде висока. Така че електроните имат по-малко енергия, когато заемат орбитала V, и тази енергия е дори по-малка от тази, която биха имали, ако атомите бяха безкрайно отдалечени един от друг. Тъй като в този случай има само два електрона, и двата могат да заемат по-енергетично изгодна орбитала, ако спиновете им са антипаралелни (принцип на Паули). Следователно енергията на система, състояща се от два водородни атома, намалява с приближаването на атомите един към друг и за да се отстранят атомите един от друг, ще е необходима енергия, равна на енергията на образуване на стабилна водородна молекула H2. Обърнете внимание, че необходимо условие за съществуването на водородна молекула е преференциалното локализиране на електрони между ядрата в съответствие с това, което вече казахме по-горе. Молекулярна орбитала Vсе нарича свързваща орбитала, а орбиталата Ж- разхлабване.
Нека сега разгледаме подхода на два атома хелий (атомен номер 2). Тук също има припокриване 1 с-орбитали води до образуването на две молекулни орбитали, едната от които отговаря на по-ниска, а другата на по-висока енергия. Този път обаче 4 електрона трябва да бъдат поставени в орбиталите, по 2 електрона от всеки хелиев атом. Нискоенергийната свързваща орбитала може да бъде запълнена само от две от тях, другите две трябва да заемат високоенергийната орбитала Ж. Намаляването на енергията поради благоприятното разположение на първата двойка е приблизително равно на увеличението на енергията поради неблагоприятното разположение на втората двойка. Сега сближаването на атомите не осигурява никаква печалба в енергия и молекулярен хелий He 2 не се образува. Това може удобно да се илюстрира с помощта на диаграма (фиг. 3); различните орбитали върху него са представени като енергийни нива, в които могат да пребивават електрони. Последните са обозначени със стрелки, сочещи нагоре и надолу, за да се разграничи посоката на завъртанията. Два електрона могат да заемат една и съща орбитала само ако спиновете им са антипаралелни.
Тези общи принципи се следват при образуването на молекули от атоми. Веднага щом два атома се доближат толкова много, че техните атомни орбитали (АО) започват да се припокриват, се появяват две молекулни орбитали (МО): едната свързваща, другата антисвързваща. Ако всеки АО има само един електрон, и двата могат да заемат свързваща МО с по-ниска енергия от АО и да образуват химична връзка. Връзките от този тип, сега наричани ковалентни, отдавна са известни на химиците (идеята за ковалентна връзка е в основата на октетната теория на свързването, формулирана от американския физикохимик Г. Луис през 1916 г.). Образуването им се обяснява с споделянето на двойка електрони от взаимодействащи атоми. Според съвременните концепции силата на връзката зависи от степента на припокриване на съответните орбитали. Всичко по-горе предполага, че връзките между атомите могат да се образуват чрез споделяне не само на два, но и на един или три електрона. Въпреки това, те ще бъдат по-слаби от обикновените ковалентни връзки поради следните причини. При образуване на едноелектронна връзка енергията само на един електрон намалява, а при връзка, образувана в резултат на споделяне на три електрона, енергията на два от тях намалява, а на третия, напротив , нараства, компенсирайки намаляването на енергията на един от първите два електрона. В резултат на това получената триелектронна връзка се оказва два пъти по-слаба от обикновената ковалентна връзка.
Споделянето на един и три електрона възниква по време на образуването на молекулния водороден йон H 2 + и съответно на молекулата HHe. Като цяло, връзките от този тип са редки и съответните молекули са силно реактивни.
Валентност. Донорно-акцепторни връзки.
Всичко по-горе предполага, че атомите могат да образуват толкова ковалентни връзки, колкото техните орбитали са заети от един електрон, но това не винаги е така. [В приетата схема за запълване на АО първо се посочва номерът на обвивката, след това видът на орбиталата и след това, ако в орбиталата има повече от един електрон, техният номер (горен индекс). И така, запишете (2 с) 2 означава, че на с-орбиталите на втората обвивка съдържат два електрона.] Въглероден атом в основно състояние (3 Р) има електронна конфигурация (1 с) 2 (2с) 2 (2стр x)(2 стр y), докато две орбитали не са запълнени, т.е. съдържат по един електрон. Двувалентните въглеродни съединения обаче са много редки и са силно реактивни. Обикновено въглеродът е четиривалентен и това се дължи на факта, че за прехода му към възбуден 5 С- състояние (1 с) 2 (2с) (2стр x)(2 стр y)(2 стр z) При четири незапълнени орбитали е необходима много малко енергия. Енергийни разходи, свързани с преход 2 с-електрон към свободен 2 Р-орбитални, са повече от компенсирани от енергията, освободена при образуването на две допълнителни връзки. За образуването на незапълнени АО е необходимо този процес да бъде енергийно благоприятен. Азотният атом с електронна конфигурация (1 с) 2 (2с) 2 (2стр x)(2 стр y)(2 стр z) не образува петвалентни съединения, тъй като енергията, необходима за преноса на 2 с-електрон за 3 д-орбитална за образуване на петвалентна конфигурация (1 с) 2 (2с)(2стр x)(2 стр y)(2 стр z)(3 д), е твърде голям. По същия начин, атоми на бор с обичайната конфигурация (1 с) 2 (2с) 2 (2стр) могат да образуват тривалентни съединения, когато са във възбудено състояние (1 с) 2 (2с)(2стр x)(2 стр y), което се случва по време на преход 2 с-електрон за 2 Р-AO, но не образува петвалентни съединения, тъй като преходът към възбудено състояние (1 с)(2с)(2стр x)(2 стр y)(2 стр z), поради прехвърлянето на един от 1 с-електроните на по-високо ниво изискват твърде много енергия. Взаимодействието на атомите с образуването на връзка между тях става само при наличие на орбитали с близки енергии, т.е. орбитали с едно и също главно квантово число. Съответните данни за първите 10 елемента от периодичната таблица са обобщени по-долу. Валентното състояние на атома е състоянието, в което той образува химични връзки, например състояние 5 Сза четиривалентен въглерод.
| ВАЛЕНТНИ СЪСТОЯНИЯ И ВАЛЕНТНОСТИ ПЪРВИТЕ ДЕСЕТ ЕЛЕМЕНТА ОТ ПЕРИОДИЧНАТА СИСТЕМА |
|||
| елемент | Основно състояние | Нормално валентно състояние | Редовна валентност |
| з | (1с) | (1с) | 1 |
| Той | (1с) 2 | (1с) 2 | 0 |
| Ли | (1с) 2 (2с) | (1с) 2 (2с) | 1 |
| Бъда | (1с) 2 (2с) 2 | (1с) 2 (2с)(2стр) | 2 |
| б | (1с) 2 (2с) 2 (2стр) | (1с) 2 (2с)(2стр x)(2 стр y) | 3 |
| ° С | (1с) 2 (2с) 2 (2стр x)(2 стр y) | (1с) 2 (2с)(2стр x)(2 стр y)(2 стрз) | 4 |
| н | (1с) 2 (2с) 2 (2стр x)(2 стр y)(2 стрз) | (1с) 2 (2с) 2 (2стр x)(2 стр y)(2 стрз) | 3 |
| О | (1с) 2 (2с) 2 (2стр x) 2 (2 стр y)(2 стрз) | (1с) 2 (2с) 2 (2стр x) 2 (2 стр y)(2 стрз) | 2 |
| Е | (1с) 2 (2с) 2 (2стр x) 2 (2 стр y) 2 (2 стрз) | (1с) 2 (2с) 2 (2стр x) 2 (2 стр y) 2 (2 стрз) | 1 |
| не | (1с) 2 (2с) 2 (2стр x) 2 (2 стр y) 2 (2 стрз) 2 | (1с) 2 (2с) 2 (2стр x) 2 (2 стр y) 2 (2 стрз) 2 | 0 |
Тези модели се проявяват в следните примери:
Всичко по-горе се отнася само за неутрални атоми. Йоните и съответните атоми имат различен брой електрони; йоните могат да имат същата валентност като другите атоми със същия брой електрони. По този начин N + и B – йони имат същия брой електрони (шест) като неутрален въглероден атом и съответно те са четиривалентни. Амониеви йони NH 4 + и борен хидрид BH 4 – образуват комплексни соли и са подобни по своята електронна конфигурация на метан CH 4.
Нека сега приемем, че молекулите на амоняка NH 3 и борния трифлуорид BF 3 са доближени една до друга. Когато един електрон се прехвърли от азотен атом към борен атом, получаваме два йона, NH 3 + и BF 3 –, всеки със свободна орбитала, което може да доведе до образуването на ковалентна връзка. Молекулата H 3 N–BF 3 е електронен аналог на 1,1,1-трифлуороетан H 3 C–CF 3 . Връзките, образувани в резултат на междуатомен пренос на електрони, последван от образуване на ковалентна връзка, се наричат донорно-акцепторни.
Геометрия на молекулите. Хибридизация.
Всички атомни орбитали с изключение на с, са сферично асиметрични и степента на тяхното припокриване с АО на други атоми зависи от взаимната ориентация на орбиталите. Така, Р-AO ще се припокрие с AO на друг атом в най-голяма степен, ако последният е разположен по протежение на неговата ос (фиг. 4, А). Това означава, че връзките, образувани в резултат на припокриващи се АО, трябва да имат специфична геометрия. Помислете за въглеродния атом в 5 С- състояние. Има един електрон на три Р-орбитали и в четвъртата, сферично симетрични с-орбитали. Изглежда, че трите връзки, които образува, ще бъдат различни от четвъртата, докато Р-връзките ще бъдат разположени във взаимно перпендикулярни посоки по осите Р-AO. Всъщност се наблюдава различна, напълно симетрична картина. Най-лесният начин да го обясните е по следния начин. Орбитален комплект (2 с)+(2стр x)+(2 стр y)+(2 стр z) е определен обем „орбитално пространство“, способен да побере четири двойки електрони. Можем да получим еквивалентно описание на тази ситуация, като смесим всички орбитали и разделим сумата им на четири равни части, така че всяка от получените смесени или хибридни орбитали да съдържа една двойка електрони. Следователно 5 С-състоянието на въглерода може да бъде представено като (1 с) 2 (T 1)(T 2)(T 3)(T 4), където t i– хибридни орбитали, което успешно обяснява образуването на симетрична четиривалентна въглеродна молекула. Нека сега разгледаме какво се случва при смесване Р-AO s с-AO. Укрепване на едната половина Р- намесата на дъмбела неизменно ще бъде придружена от отслабване на другата му половина (фиг. 4, b), което води до образуването на асиметрична хибридна орбитала (фиг. 4, V). Той ефективно ще се припокрива с други орбитали, ориентирани в същата посока, образувайки доста силни връзки. Това е една от причините, поради които въглеродният атом предпочита да образува връзки чрез AO хибридизация. Но има и друга причина. Помислете за типично четиривалентно въглеродно съединение, като метан CH4. В него всеки водороден атом се държи близо до въглероден атом от двойка споделени електрони. Тези двойки се отблъскват взаимно и оптималната конфигурация на молекулата е тази, при която те са на възможно най-голямото разстояние една от друга. В този случай водородните атоми ще бъдат разположени във върховете на правилен тетраедър, а въглеродният атом ще бъде в неговия център. Тази геометрия може да се реализира с помощта на т.нар. sp 3-хибридни орбитали, всяка образувана от 1/4 от 2 с-AO и един от 2 Р-AO. Всички тези орбитали са еднакви по форма, лесно образуват връзки и са насочени от въглеродния атом в центъра на правилен тетраедър към четирите му върха (фиг. 1, Ж).
Азотният атом може да образува връзки само с 2 Р-AO, ъглите между които биха били 90°, но взаимното отблъскване на двойки свързващи електрони и двойки несвързващи електрони на 2-ра обвивка е сведено до минимум, ако „тетраедричните“ участват в образуването на връзки sp 3 -орбитали. Тук обаче се очертава още една особеност. За N+ йонна конфигурация (1 с) 2 (2с)(2стр) 3 и (1 с) 2 (T) 4 , където T – sp 3-хибридните АО са наистина еквивалентни. Друго нещо е неутралния азотен атом, чийто 7-ми електрон може да заема или 2 с-AO и след това получавате конфигурацията (1 с) 2 (2с)(2стр) 4 , или T-AO в конфигурация (1 с) 2 (T) 5 . От 2 с-AO се намира под 2 стр-AO и следователно по-нисък от всеки sp-хибридна орбитала, първата конфигурация се оказва енергийно по-благоприятна и може да се очаква, че при равни други условия тривалентният азот ще предпочете „нехибридизираната” конфигурация. Обаче взаимното отблъскване на електронните двойки очевидно е достатъчно за възникване на хибридизация, при която ъглите на връзката в азотно съединение като амоняк NH3 са близки до съответните ъгли в правилен тетраедър, т.е. до 109°. Същото важи и за двувалентния кислород в състава на водната молекула H 2 O. Във всички тези случаи свързаните атоми заемат три (или два) върха на тетраедъра, а двойки самотни електрони на 2-ра обвивка заемат останалите върхове.
Подобни разсъждения се прилагат и за други типични елементи от групи IV, V и VI на периодичната таблица. Четиривалентните елементи от група IV (Si, Ge, Sn и Pb) винаги образуват тетраедрични структури, но други елементи от групи V и VI (P, S, As, Se, Sb, Te) се различават от азота и кислорода и образуват съединения с връзка ъгли, близки до 90°. Очевидно, поради по-големия размер на тези атоми, взаимното отблъскване на валентните електрони не е достатъчно, за да позволи хибридизацията, наблюдавана за N и O.
Връзки, включващи d-орбитали.
За разлика от азота, фосфорният атом може да образува пет ковалентни връзки. В основно състояние фосфорът има конфигурация (1 с) 2 (2с) 2 (2стр) 6 (3с) 2 (3стр x)(3 стр y)(3 стр z) и е тривалентен, образувайки, подобно на азота, съединения от типа PF 3. В този случай обаче е възможно да участвате 3 с-електрони при образуването на връзки, тъй като д-AO (3 д) имат едно и също главно квантово число. Наистина, петвалентни фосфорни съединения от типа PF 5 също са известни, където фосфорът е в състояние на валентност +5, в съответствие с електронната конфигурация (1 с) 2 (2с) 2 (2стр) 6 (3с)(3стр x)(3 стр y)(3 стр z)(3 д); връзките в този случай се образуват в резултат sp 3 д-хибридизация (т.е. в резултат на смесване на един с-, три Р- и едно д-AO). Оптималната структура от гледна точка на намаляване на взаимното отблъскване на двойки валентни електрони е триъгълна бипирамида (фиг. 5, А). Сярата може да бъде не само двувалентна, но и четиривалентна (SF 4) и шествалентна (SF 6), намирайки се в състояния (1 с) 2 (2с) 2 (2стр) 6 (3с) 2 (3стр x)(3 стр y)(3 стр z)(3 д) и (1 с) 2 (2с) 2 (2стр) 6 (3с)(3стр x)(3 стр y)(3 стр z)(3 д 1)(3д 2) съответно. В четиривалентните серни съединения взаимното отблъскване на електроните на 3-та обвивка се оптимизира чрез хибридизация на орбиталите на всички негови електрони. Структурата на съединения от този тип е подобна на структурата на PF 5, но един от върховете на триъгълната бипирамида е зает от двойка самотни електрони на 3-та обвивка (фиг. 5, b). В шествалентните серни съединения взаимното отблъскване на електроните е сведено до минимум, когато sp 3 д 2 -
хибридизация, когато всички орбитали са еквивалентни и насочени към върховете на правилен октаедър (фиг. 5, V).
Досега разглеждахме само онези елементи от периодичната таблица, които имат черупки с д-орбиталите са или напълно запълнени, или напълно празни. Нека сега се спрем на преходните елементи, в които тези черупки не са напълно запълнени. Енергията на електроните в различни орбитали на 3-тата обвивка нараства в следния ред: 3 с p d; всички орбитали са твърде далеч от орбиталите на втората обвивка, за да настъпи хибридизация. В същото време 3 д-орбиталите и орбиталите на 4-тата обвивка са енергийно достатъчно близки, за да е възможно взаимодействие 3 д-, 4с- и 4 Р-орбитали и преходните елементи от Sc към Cu могат да образуват ковалентни връзки чрез хибридизиране на тези орбитали. Във всички случаи, когато има две 3 д-орбитали, образуването на връзка става през д 2 sp 3-хибридизация, докато хибридните орбитали са подобни по форма на sp 3 д 2 -орбитали. Елементите в съединения от този тип са шествалентни, а самите молекули на съединенията имат формата на октаедър (фиг. 5, V). Повечето от тях съдържат йони и могат да се считат за образувани от взаимодействието на йон от централния атом с шест молекули, всяка от които има двойка несподелени електрони. Ковалентните връзки с централния йон се наричат донорно-акцепторни връзки. Прост пример за такова съединение е хексаминният йон на тривалентен кобалт Co(NH 3) 6 3+. Йонът Co 3+ има електронна конфигурация (1 с) 2 (2с) 2 (2стр) 6 (3с) 2 (3стр) 6 (3д 1) 2 (3д 2) 2 (3д 3) 2 и три от неговите пет 3 са напълно заети д-орбитали, а две са 3 д-AO са безплатни. Тези орбитали могат да хибридизират с 4 с- и 4 Р-AO с образуването на шест октаедра д 2 sp 3-орбитали; всички те са свободни и могат да участват в образуването на акцепторни връзки с шест амонячни молекули.
Друга картина се наблюдава, когато централният атом има само един свободен д- орбитален. Пример е двойно зареденият никелов йон Ni 2+, в който оптималната конфигурация възниква, когато се образуват четири връзки с помощта на dsp 2 -орбитали. Тези орбитали лежат в една и съща равнина под ъгъл от 90° една спрямо друга.
Множество връзки.
Едно от добре познатите въглеродни съединения е етилен C 2 H 4, в който всеки въглероден атом е свързан само с три други атома. По аналогия с бора можем да приемем, че оптималната геометрия ще бъде такава, че sp 2-хибридни орбитали лежат в една и съща равнина. В този случай всеки въглероден атом ще има един неизползван (в sp 2 -хибридизация) Р-орбитала, която съдържа един от четирите валентни електрона. Ако всичките шест етиленови атома лежат в една и съща равнина, тогава двата неизползвани Р-AO се припокриват един с друг, както е показано на фиг. 6, А. Това припокриване води до образуването на двойка МО: едно свързване (фиг. 6, b) и едно разхлабване (фиг. 6, V). Тъй като всеки от тях съдържа само един електрон, те могат да образуват нискоенергийна свързваща MO. Това създава допълнителна връзка между въглеродните атоми и структурната формула на етилена има формата
Този нов тип връзка се различава от тези, образувани от припокриващи се орбитали по линията на свързване на атомите в две отношения. Последният тип връзки, C–C единични връзки, са аксиално симетрични и следователно не се влияят от въртенето на групите, които свързват. Напротив, припокриване Р-орбитали зависи от това дали всичките шест атома в етиленовата молекула лежат в една и съща равнина, тъй като за оптимално припокриване Р-AO трябва да са успоредни. По този начин, докато въртенето около единична C–C връзка може да се случи относително свободно, въртенето около двойна C=C връзка е много трудно. Наистина, молекулата на етилена е твърда, плоска структура. Втората разлика се отнася до степента на припокриване на орбитите. Кръстосано припокриване Р-AO е относително неефективен и следователно този тип връзка е слаб. Следователно етиленът е химически по-активен от наситените съединения, които имат само единични връзки.
S-връзки и с напречно припокриване – стр- връзки.
Молекулите на някои съединения, например ацетилен C 2 H 2, съдържат тройни връзки. В тях всеки въглероден атом е свързан със своя съсед с- формирани връзки sp-хибридни орбитали. Те са колинеарни, така че четири атома в ацетиленовата молекула лежат на една и съща права линия. Почивка Р-AO въглеродните атоми, когато се припокриват, образуват два стр- връзки.
Ароматни съединения.
Молекулата на бензен C 6 H 6 е представена като шестчленен пръстен от въглеродни атоми, към всеки от които има прикрепен водороден атом (фиг. 7, А). Тъй като всеки въглероден атом има три съседа, може да се приеме, че в резултат на това се образуват съответните връзки sp 2-хибридизация и лежат в една равнина под ъгъл 120° един спрямо друг. Наистина, молекулата на бензена е плоска структура. Неизползван Р-AO въглеродни атоми могат да се образуват стр-връзки (фиг. 7, b), обаче, за бензена ситуацията се оказва по-сложна, отколкото в случаите, разгледани по-горе, когато връзките се образуват в резултат на припокриващи се AO двойки. В бензен 2 Р- AO на всеки въглероден атом трябва да се припокрива еднакво ефективно с 2 Р-AO на всички съседни атоми. (Тук можем да направим аналогия с множествена интерференция на вълни, като сравним припокриването на орбиталите в молекула бензен с припокриването на вълни, дифрактирани от два процепа или върху дифракционна решетка.) В резултат на това за бензена получаваме набор от пръстени молекулярни орбитали, покриващи всичките шест въглеродни атома (фиг. 7, V). Общата енергия на системата с такава електронна конфигурация е по-малка от ако Р-АО образуваха обикновени по двойки стр- връзки. Наистина, бензенът е по-стабилен и по-малко активен, отколкото би се очаквало въз основа на неговата „класическа“ структура (фиг. 7, Ж). Всички връзки в неговата молекула са симетрични и дължините им са еднакви, а по сила заемат междинно положение между единичните и двойните връзки. Известни са и други съединения, в които стр-електроните участват в образуването на „многоцентрови” МО и за които се наблюдават подобни характеристики на дължините на връзките и химичната активност. 
Съединения, съдържащи многоцентрови връзки.
Дори в такива прости молекули като CH 4 отделните молекулни орбитали задължително взаимодействат една с друга. Следователно идеята за локализирани двуцентрови ковалентни връзки може да се разглежда само като известно приближение. Обикновено обаче тези взаимодействия са слаби, тъй като степента на орбитално припокриване е малка (с изключение на стр-MO в ароматни и подобни съединения). Въпреки това не можем да изключим съществуването на молекули с множество припокриващи се АО, отговорни за образуването на връзки чрез споделяне на електрони с три или повече атома. Пример е диборан B 2 H 6, който има шест двойки валентни електрони; това не е достатъчно за образуване на седемте връзки, необходими за създаване на класическата H 3 B–BH 3 структура. H. Longuet-Higgins предложи структурата на диборан, показана на фиг. 8, А. В тази структура централните водородни атоми са свързани чрез трицентрови връзки, образувани в резултат на припокриване sp 3-хибридни орбитали на два борни атома с 1 с-AO на водородния атом (фиг. 8, b). Четири от шестте двойки валентни електрони участват в образуването на обикновените с-връзки с „крайни“ водородни атоми и две двойки връзки с три центъра. По-сложен пример за многоцентрова връзка е молекулата на дибензен хром (фиг. 8, V). Бензеновите пръстени в тази молекула са свързани с металния атом чрез сложни многоцентрови орбитали, образувани чрез припокриване стр-Бензен MO с 3 д-, 4с- и 4 Р-AO на централния атом. Известни са други подобни съединения, които имат структура тип сандвич. 
Перспективи.
Досега общите принципи на структурата на молекулите могат да се считат за установени. Разработени са физикохимични методи за определяне структурата на сложни молекули, включително биологични. В близко бъдеще е възможен напредък в две свързани посоки. Трябва да очакваме, първо, повишаване на точността на квантово-механичните изчисления и, второ, подобряване на експерименталните методи за измерване на съответните молекулни параметри.
Според съвременните представи:
атом е електрически неутрална частица, състояща се от положително заредено ядро и отрицателно заредени електрони.
Неправилно е да се каже, че „атомът е най-малката частица от химичен елемент, която запазва всички свои химични свойства“, т.к. химичен елемент – това е вид частици (атоми, йони, ядра) с определен ядрен заряд; следователно елементът не е направен от атоми!
В допълнение, химичните свойства са енергията и скоростта на химическа реакция и те зависят не само от състава на реагиращата частица, но и от нейното енергийно състояние, геометрична форма и т.н., следователно не са атоми (и молекули) които имат химични свойства, но съвкупността им е химични вещества.
Молекула - това е електрически неутрален най-малък набор от атоми, които образуват определена структура чрез химични връзки, определящи състава на веществото.
Според съвременните концепции веществата в състояние на газ и пара са изградени от молекули. В твърдо състояние само вещества, чиято кристална решетка има молекулярна структура(повечето органични вещества; неметали, с изключение на бор, силиций, алотропни модификации на въглерод; въглероден диоксид CO 2; вода H 2 O).
Повечето твърди неорганични вещества нямат молекулна структура: тяхната решетка не се състои от молекули, а от други частици (йони, атоми); те съществуват под формата на макротела (кристал NaCl, кварцова друза, парче желязо и др.). Веществата с немолекулна структура включват соли, метални оксиди, диамант, силиций, метали и др.
Химическата връзка между молекулите на вещества с молекулярна структура е по-малко силна, отколкото между атомите в молекулата, поради което техните точки на топене и кипене са относително ниски. Веществата с немолекулна структура имат много силни химични връзки между частиците, поради което техните точки на топене и кипене са високи.
1.3.2. Маси на атоми и молекули. Къртица
Масите на атомите и молекулите са изключително малки, затова за тях се използва специална мерна единица - единица атомна маса (съкратено като „a.u.m.“):
1 а. е. м. = 1,66·10 –27 кг.
Например, абсолютната маса на алуминиев атом е:
m o (Al) = 4,482·10 –26 kg = 27 a. Яжте.
По-често се използва безразмерен количества– относителни атомни и молекулни маси.
Относителна атомна маса А r – число, показващо колко пъти масата на даден атом е по-голяма от 1/12 масата на 12 C въглероден атом.
Например:
A r (Al) = = 27.
Относително молекулно тегло М r – число, показващо колко пъти масата на дадена молекула е по-голяма от 1/12 масата на 12 C въглероден атом.
Например:
M r (SO 2) =  = 64.
= 64.
Наред с единиците за маса и обем, в химията се използва и единица за количество на вещество, наречена мол (съкратено „мол”).
Къртица - това е количеството вещество, съдържащо същия брой структурни единици (атоми, молекули, йони, ядра, електрони, радикали), колкото има атоми в 0,012 kg (12 g) въглерод 12 C.
Един мол от всяко вещество съдържа Числото на Авогадро структурни звена, а именно
N A = 6,02·10 23 mol –1.
Един мол вещество има определена маса (моларна маса) и определен обем (моларен обем).
Моларна (mol) маса М е масата на 1 мол вещество, изразена в единици за маса:
M(Al) = 27 g/mol; M(H2SO4) = 98 g/mol.
Моларен (моларен) обем V м – обем на 1 мол вещество, изразен в обемни единици:
V m (CO 2 ) = 22,4 l/mol (n.s.) 1; Vm (H2O) = 18 ml/mol.
Пример 1.1 . По време на войната във Виетнам (1962–1971 г.) американските войски използваха широко дефолианти в усилията за борба с бунтовниците. Дефолиантът "агент ориндж" (оранжев реагент) предизвиква ускорено окапване на листата на дърветата. Общо 57 хиляди тона от този наркотик бяха разпръснати над джунглата, която съдържаше до 170 кг диоксин като примес. Сега този дефолиант е известен като 2,4-D (2,4-дихлорофенооцетна киселина) Изчислете масата на една молекула дефолиант (молекулна формула C 8 H 6 O 3 Cl 2): а) в грамове; б) в атомни единици за маса.
Решение:
А). За да изчислите масата на молекула 2,4-дихлорофенооцетна киселина, трябва да знаете нейната моларна маса:
M(C8H6O3Cl2) = 8 12 + 6 1 + 3 16 + 2 35.5 = 221 (g/mol).
Изчисляваме количеството вещество, като използваме следните формули:
ν = m/M; ν = N/NA,
където m е маса, M е моларна маса, N е броят на атомите или молекулите, N A = 6,02·10 23 mol –1 е константата на Авогадро.
Като комбинираме тези формули, можем да изразим масата по отношение на броя на молекулите:
m = ν · M =  .
.
Замествайки N = 1, M = 221 g/mol, N A в получената формула, намираме:
m(C8H6O3Cl2) =  = 36,7·10 –23 (g).
= 36,7·10 –23 (g).
б). Абсолютната маса на една молекула е равна на относителната молекулна маса, умножена по 1 a. Яжте.
m(C8H6O3Cl2) = 1 a. u.m. M r (C 8 H 6 O 3 Cl 2)
Относителната молекулна маса е числено равна на моларната маса:
Mr (C8H6O3CI2) = 221;
m(C8H6O3Cl2) = 1 a. e.m. · 221 = 221 a.m. Яжте.
Пример 1.2. Колко молекули има в 1 литър вода?
Решение. 1. Маса 1 л водата може да се изчисли, като се използва стойността на плътността (плътността на водата при 4C е 1 g/cm3):
m(H2O) = V(H2O) ρ(H2O);
V(H 2 O) = 1 l = 1 dm 3 = 1000 cm 3;
m(H 2 O) = 1000 cm 3 1 g/cm 3 = 1000 g.
2. По-нататъшното разсъждение може да се извърши по два начина.
Метод 1: според количеството вещество.
Използвайки формулите ν = m / M и ν = N / N A, намираме:
ν(H 2 O) = m(H 2 O) / M(H 2 O); ν(H 2 O) = 1000 g / 18 g/mol = 55,6 mol.
N(H2O) = ν(H2O)NA; N(H 2 O) = 55,6 mol 6,02 10 23 mol –1 = 334,7 10 23 = 3,35 10 25.
Метод 2: използване на пропорции.
18 g (1 mol) H 2 O съдържат 6,02·10 23 молекули;
1000 g H 2 O съдържат N молекули.
N(H 2 O) = 1000 6,02 10 23 / 18 = 3,35 10 25.
Пример 1.3. Изчислете моларния обем на алуминия, ако неговата плътност е 2,7 g/cm3.
Решение.За да изчислите моларния обем чрез плътността на дадено вещество, трябва да знаете неговата моларна маса:
ρ(Al) =  ;V m (Al) =
;V m (Al) =  .
.
V m (Al) =  = 10 cm 3 /mol = 0,01 l/mol.
= 10 cm 3 /mol = 0,01 l/mol.
Всички тела, които ни заобикалят, са изградени от атоми. Атомите от своя страна се събират в молекула. Благодарение на разликата в молекулната структура можем да говорим за вещества, които се различават едно от друго, въз основа на техните свойства и параметри. Молекулите и атомите винаги са в състояние на динамика. Докато се движат, те все още не се разпръскват в различни посоки, а се държат в определена структура, която дължим на съществуването на такова огромно разнообразие от вещества в целия свят около нас. Какви са тези частици и какви са техните свойства?
Общи понятия
Ако започнем от теорията на квантовата механика, тогава една молекула се състои не от атоми, а от техните ядра и електрони, които постоянно взаимодействат помежду си.
За някои вещества молекулата е най-малката частица, която има състава и химичните свойства на самото вещество. По този начин свойствата на молекулите от гледна точка на химията се определят от нейния състав. Но само за веществата с молекулярна структура важи правилото: химикалите и молекулите са едни и същи. За някои полимери, като етилен и полиетилен, съставът не съответства на молекулния състав.
Известно е, че свойствата на молекулите се определят не само от броя на атомите и техния тип, но и от конфигурацията и реда на свързване. Молекулата е сложна архитектурна структура, където всеки елемент стои на своето място и има свои специфични съседи. Атомната структура може да бъде повече или по-малко твърда. Всеки атом вибрира около своето равновесно положение.
Конфигурация и параметри
Случва се някои части на една молекула да се въртят спрямо други части. Така в процеса на термично движение свободната молекула придобива причудливи форми (конфигурации).
По принцип свойствата на молекулите се определят от връзката (нейния вид) между атомите и архитектурата на самата молекула (структура, форма). Така, на първо място, общата химическа теория разглежда химичните връзки и се основава на свойствата на атомите.
При силна полярност свойствата на молекулите са трудни за описание чрез дву- или триконстантни корелации, които са отлични за неполярни молекули. Затова беше въведен допълнителен параметър с диполен момент. Но този метод не винаги е успешен, тъй като полярните молекули имат индивидуални характеристики. Предложени са и параметри, които да отчитат квантовите ефекти, които са важни при ниски температури.

Какво знаем за молекулата на най-често срещаното вещество на Земята?
От всички вещества на нашата планета най-често срещаната е водата. Той буквално осигурява живот на всичко на Земята. Само вирусите могат без него, останалите живи структури съдържат предимно вода. Какви свойства на водната молекула, характерни само за нея, се използват в стопанския живот на човека и живата природа на Земята?
Това е наистина уникално вещество! Никое друго вещество не може да се похвали с набор от свойства, присъщи на водата.
Водата е основният разтворител в природата. Всички реакции, протичащи в живите организми, по един или друг начин се случват във водна среда. Тоест веществата реагират, докато са в разтворено състояние.
Водата има отличен топлинен капацитет, но ниска топлопроводимост. Благодарение на тези свойства можем да го използваме за пренос на топлина. Този принцип е включен в охлаждащия механизъм на голям брой организми. В ядрената енергетика свойствата на водната молекула доведоха до използването на това вещество като охлаждаща течност. В допълнение към способността да бъде реактивна среда за други вещества, самата вода може да влиза в реакции: фотолиза, хидратация и други.

Натуралната чиста вода е течност без мирис, цвят и вкус. Но при дебелина на слоя над 2 метра цветът става синкав.
Цялата водна молекула е дипол (два противоположни полюса). Това е диполната структура, която основно определя необичайните свойства на това вещество. Водната молекула е диамагнитна.
Стопената вода има още едно интересно свойство: нейната молекула придобива структурата на златното сечение, а структурата на веществото придобива пропорциите на златното сечение. Много от свойствата, притежавани от водната молекула, са установени чрез анализ на спектрите на абсорбцията и емисиите в газовата фаза.
Естествена история и молекулярни свойства
Всички вещества, с изключение на химичните, имат физични свойства на молекулите, включени в тяхната структура.
Във физическата наука концепцията за молекули се използва за обяснение на свойствата на твърди вещества, течности и газове. Способността на всички вещества да дифундират, техният вискозитет, топлопроводимост и други свойства се определят от подвижността на молекулите. Когато френският физик Жан Перин изучава брауновото движение, той експериментално доказва съществуването на молекули. Всички живи организми съществуват благодарение на фино балансирано вътрешно взаимодействие в структурата. Всички химични и физични свойства на веществата са от основно значение за естествените науки. Развитието на физиката, химията, биологията и молекулярната физика дава началото на науката молекулярна биология, която изучава основните явления в живота.
Използвайки статистическата термодинамика, физичните свойства на молекулите, които се определят чрез методите на молекулярната спектроскопия, във физическата химия те определят веществата, необходими за изчисляване на химичните равновесия и скоростите на тяхното установяване.

Как свойствата на атомите и молекулите се различават едно от друго?
Първо, атомите не се срещат в свободно състояние.
Молекулите имат по-богат оптичен спектър. Това се дължи на по-ниската симетрия на системата и появата на възможност за нови завъртания и трептения на ядрата. За една молекула общата енергия се състои от три енергии, които се различават по порядъка на величината на компонентите:
- електронна обвивка (оптично или ултравиолетово лъчение);
- ядрени вибрации (инфрачервена част от спектъра);
- въртене на молекулата като цяло (радиочестотен диапазон).
Атомите излъчват характерни емисии, а молекулите излъчват ивици, състоящи се от множество близко разположени линии.
Спектрален анализ
Оптичните, електрическите, магнитните и други свойства на молекулата също се определят от връзката с Данните за състоянията на молекулите и вероятният преход между тях са показани чрез молекулни спектри.
Преходите (електронни) в молекулите показват химичните връзки и структурата на техните електронни обвивки. Спектрите с по-голям брой връзки имат дълговълнови абсорбционни ленти, попадащи във видимата област. Ако едно вещество е изградено от такива молекули, то има характерен цвят. Това е всичко
Свойствата на молекулите на едно и също вещество са еднакви във всички агрегатни състояния. Това означава, че за едни и същи вещества свойствата на молекулите на течните и газообразните вещества не се различават от свойствата на твърдите вещества. Молекулата на едно вещество винаги има една и съща структура, независимо от агрегатното състояние на самото вещество.

Електрически характеристики
Начинът, по който веществото се държи в електрическо поле, се определя от електрическите характеристики на молекулите: поляризуемост и постоянен диполен момент.
Диполният момент е електрическата асиметрия на молекулата. Молекулите, които имат център на симетрия, като H2, нямат постоянен диполен момент. Способността на електронната обвивка на молекулата да се движи под въздействието на електрическо поле, в резултат на което в нея се образува индуциран диполен момент, е поляризуемост. За да се намери стойността на поляризуемостта и диполния момент, е необходимо да се измери диелектричната константа.
Поведението на светлинна вълна в променливо електрическо поле се характеризира с оптичните свойства на веществото, които се определят от поляризуемостта на молекулата на това вещество. Пряко свързани с поляризуемостта са: разсейването, пречупването, оптичната активност и други явления на молекулярната оптика.
Често можете да чуете въпроса: „От какво, освен от молекулите, зависят свойствата на дадено вещество?“ Отговорът е съвсем прост.
Свойствата на веществата, в допълнение към изометрията и кристалната структура, се определят от температурата на околната среда, самото вещество, налягането и наличието на примеси.

Химия на молекулите
Преди формирането на науката за квантовата механика природата на химичните връзки в молекулите беше неразгадана мистерия. Класическата физика не може да обясни посоката и наситеността на валентните връзки. След създаването на основна теоретична информация за химичните връзки (1927 г.), използвайки примера на най-простата молекула H2, теорията и методите за изчисление започнаха постепенно да се подобряват. Например, въз основа на широкото използване на метода на молекулярната орбита и квантовата химия, стана възможно да се изчислят междуатомните разстояния, енергията на молекулите и химичните връзки, разпределението на електронната плътност и други данни, които напълно съвпадат с експерименталните.
Вещества с еднакъв състав, но различна химична структура и различни свойства се наричат структурни изомери. Те имат различни структурни формули, но еднакви молекулни формули.
Известни са различни видове структурна изомерия. Разликите са в структурата на въглеродния скелет, позицията на функционалната група или позицията на множествената връзка. Освен това все още има пространствени изомери, в които свойствата на молекулата на веществото се характеризират със същия състав и химична структура. Следователно и двете им структурни и молекулни формули са еднакви. Разликите са в пространствената форма на молекулата. За изобразяване на различни пространствени изомери се използват специални формули.
Има съединения, които се наричат хомолози. Те са сходни по структура и свойства, но се различават по състав с една или повече СН2 групи. Всички подобни по структура и свойства вещества са обединени в хомоложни серии. След като сте проучили свойствата на един хомолог, можете да говорите за всеки друг от тях. Наборът от хомолози е хомоложна серия.
Когато структурите на материята се трансформират, химичните свойства на молекулите се променят драматично. Дори най-простите съединения служат като пример: метанът, комбинирайки се дори с един кислороден атом, се превръща в токсична течност, наречена метанол (метилов алкохол - CH3OH). Съответно неговата химическа комплементарност и ефект върху живите организми стават различни. Подобни, но по-сложни промени възникват при модифициране на структурите на биомолекулите.
Химичните молекулни свойства силно зависят от структурата и свойствата на молекулите: от нея и от геометрията на самата молекула. Това работи особено при биологично активни съединения. Коя конкурентна реакция ще бъде преобладаваща, често се определя само от пространствени фактори, които от своя страна зависят от изходните молекули (тяхната конфигурация). Една молекула с „неудобна“ конфигурация изобщо няма да реагира, докато друга, със същия химичен състав, но с различна геометрия, може да реагира незабавно.
Голям брой биологични процеси, наблюдавани по време на растеж и размножаване, са свързани с геометрични връзки между реакционните продукти и изходните вещества. За ваша информация: ефектът на значителен брой нови лекарства се основава на подобна молекулярна структура на някакво съединение, което е вредно от биологична гледна точка за човешкото тяло. Лекарството заема мястото на вредната молекула и затруднява действието му.
Химичните формули се използват за изразяване на състава и свойствата на молекулите на различни вещества. Въз основа на молекулното тегло се установява атомното съотношение и се съставя емпирична формула.
Геометрия
Геометричната структура на молекулата се определя, като се вземе предвид равновесното разположение на атомните ядра. Енергията на взаимодействие между атомите зависи от разстоянието между ядрата на атомите. На много големи разстояния тази енергия е нула. Когато атомите се сближат, започва да се образува химическа връзка. Тогава атомите се привличат силно един към друг.
Ако се наблюдава слабо привличане, тогава не е необходимо образуването на химична връзка. Ако атомите започнат да се приближават на по-близки разстояния, между ядрата започват да действат електростатични отблъскващи сили. Пречка за близкия подход на атомите е несъвместимостта на вътрешните им електронни обвивки.

Размери
Невъзможно е да се видят молекули с просто око. Те са толкова малки, че дори микроскоп с 1000-кратно увеличение няма да ни помогне да ги видим. Биолозите наблюдават бактерии с размери 0,001 mm. Но молекулите са стотици и хиляди пъти по-малки от тях.
Днес структурата на молекулите на определено вещество се определя чрез дифракционни методи: неутронна дифракция, рентгенов дифракционен анализ. Има още вибрационна спектроскопия и електронен парамагнитен метод. Изборът на метод зависи от вида на веществото и неговото състояние.
Размерът на молекулата е относителна стойност, като се вземе предвид електронната обвивка. Въпросът е в разстоянията на електроните от атомните ядра. Колкото по-големи са, толкова по-малка е вероятността да се намерят електроните на молекулата. На практика размерът на молекулите може да се определи, като се вземе предвид равновесното разстояние. Това е разстоянието, на което самите молекули могат да се доближат, когато са плътно опаковани в молекулярен кристал и в течност.
Големите разстояния са склонни да привличат молекули, а малките разстояния, напротив, са склонни да отблъскват. Следователно рентгеновият дифракционен анализ на молекулярни кристали помага да се намери размерът на молекулата. Използвайки коефициента на дифузия, топлопроводимостта и вискозитета на газовете, както и плътността на веществото в кондензирано състояние, е възможно да се определи порядъкът на големината на молекулните размери.