Nodarbības mērķi:
- pastāstiet skolēniem par molekulām un atomiem un iemāciet tos atšķirt.
Nodarbības mērķi:
Izglītojoši: apgūt jaunu materiālu par tēmu “Molekulas un atomi”;
Attīstošs: veicināt domāšanas un izziņas prasmju attīstību; sintēzes un analīzes metožu apgūšana;
Izglītība: pozitīvas motivācijas veicināšana mācībām.
Pamatjēdzieni:
Molekula– elektriski neitrāla daļiņa, kas sastāv no diviem vai vairākiem atomiem, kas savienoti ar kovalentām saitēm; mazākā vielas daļiņa, kurai ir tās īpašības.
Atom– mazākā ķīmiski nedalāmā elementa daļa, kas ir tā īpašību nesēja; sastāv no elektroniem un atoma kodola. Dažāds skaits dažādu atomu, kas savienoti ar starpatomiskām saitēm, veido molekulas.
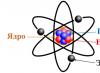
Atomu kodols– atoma centrālā daļa, kurā ir koncentrēti vairāk nekā 99,9% tā masas.
3. Kāpēc daļiņas, kas veido viela?
4.Kā izskaidrot drēbju izžūšanu pēc mazgāšanas?
5. Kāpēc cietās vielas, kas izgatavotas no daļiņām, šķiet cietas?
Molekulas.
2. Kā sauc daļiņas, kas veido molekulas?
3.Aprakstiet eksperimentu, ko var izmantot, lai noteiktu molekulas izmēru.
4. Vai vienas vielas molekulas atšķiras dažādos agregācijas stāvokļos?
5.Kas ir atoms un no kā tas sastāv
Mājasdarbs.
Izmēģiniet eksperimentu mājās, lai izmērītu jebkuras vielas molekulas izmēru.
Interesanti to zināt.
Jēdzienu par atomu kā mazāko nedalāmo matērijas daļu pirmo reizi formulēja senindiešu un sengrieķu filozofi. 17. un 18. gadsimtā ķīmiķi varēja eksperimentāli apstiprināt šo ideju, parādot, ka dažas vielas ar ķīmiskām metodēm nav iespējams tālāk sadalīt to sastāvdaļās. Tomēr 19. gadsimta beigās un 20. gadsimta sākumā fiziķi atklāja subatomiskās daļiņas un atoma salikto struktūru, un kļuva skaidrs, ka atoms nav īsti "nedalāms".
Starptautiskajā ķīmiķu kongresā Karlsrūē (Vācija) 1860. gadā tika pieņemtas molekulas un atoma jēdzienu definīcijas. Atoms ir mazākā ķīmiskā elementa daļiņa, kas ir daļa no vienkāršām un sarežģītām vielām.
Atomu un molekulu fizika ir fizikas nozare, kas pēta atomu, molekulu un to sarežģītāko asociāciju (kopu) iekšējo struktūru un fizikālās īpašības, kā arī fizikālās parādības zemas enerģijas elementāru objektu un elementārdaļiņu mijiedarbības aktu laikā.
Pētot atomu un molekulu fiziku, galvenās ir tādas eksperimentālās metodes kā spektroskopija un masas spektrometrija ar visām to paveidiem, daži hromatogrāfijas veidi, rezonanses metodes un mikroskopija, kvantu mehānikas teorētiskās metodes, statistiskā fizika un termodinamika. Atomu un molekulu fizika ir cieši saistīta ar molekulāro fiziku, kas pēta ķermeņu (kolektīvās) fizikālās īpašības dažādos agregācijas stāvokļos, pamatojoties uz to mikroskopisko struktūru, kā arī ar dažām ķīmijas nozarēm.
Īsi apskatīsim atomu-molekulārās teorijas attīstības vēsturi:
Bibliogrāfija
1.Stunda par tēmu “Molekulas un atomi” S.V. Gromovs, I.A. Dzimtene, fizikas skolotāji.
2. Nodarbība par tēmu “Matērijas struktūra” Fonins Iļja Aleksandrovičs, Kamzeeva Jeļena Jevgeņijevna, fizikas skolotāja, Pašvaldības izglītības iestādes 8. ģimnāzija, Kazaņa.
3.G. Oster. Fizika. Problēmu grāmata. Mīļots ceļvedis. - M.: Rosman, 1998.
4. Meyani A. Lielā eksperimentu grāmata skolēniem. M.: “Rosmen”. 2004. gads
5. Globālā fizika "Atomi un molekulas".
Rediģēja un nosūtīja Borisenko I.N.
Strādāja pie nodarbības:
Gromovs S.V.
Fonins I.A.
Ļoti bieži var dzirdēt viedokli, ka atomam, kas ir neatņemama molekulas sastāvdaļa, ir tādas pašas īpašības un līdzīga struktūra. Šai pozīcijai ir tiesības pastāvēt tikai daļēji, jo daļiņām ir kopīgas un atšķirīgas iezīmes. Lai sāktu, pietiek apsvērt divu objektu īpašības un, pamatojoties uz tiem, izdarīt turpmākus secinājumus.
Atomu var uzskatīt par viendabīgas vielas elementārdaļiņa. Šāda viela pēc definīcijas sastāv tikai no viena ķīmiskā elementa (C, N, O un citi no periodiskās tabulas). Tā ir mazākā šādu elementu daļa, kas var būt to īpašību nesēja, ko sauc par atomu. Saskaņā ar jaunākajām mūsdienu koncepcijām atoms sastāv no trim sastāvdaļām: protoniem, neitroniem un elektroniem.

Pirmās divas apakšdaļiņas kopā veido pamata kodols, kam ir pozitīvs lādiņš. Elektroni, kas pārvietojas ap kodolu, ievieš kompensācijas lādiņu ar pretēju zīmi. Tādējādi tiek izdarīts pirmais secinājums, ka lielākā daļa atomu ir elektriski neitrāli. Kas attiecas uz atlikušo daļu, dažādu fizikālu un ķīmisku procesu dēļ atomi var piesaistīt vai atbrīvot elektronus, kas izraisa lādiņa parādīšanos. Atomam ir masa un izmērs (ko nosaka kodola izmērs), un tas nosaka vielas ķīmiskās īpašības.
Molekula
Molekula ir vielas minimālā struktūrvienība. Šāda viela var sastāvēt no vairākiem ķīmiskiem elementiem. Tomēr viena ķīmiskā elementa – inertās gāzes argona – monoatomisku vielu var uzskatīt arī par molekulu. Tāpat kā atomi, tas ir elektriski neitrāls. Ir iespējams jonizēt molekulu, taču tas ir daudz grūtāk: atomi molekulas iekšpusē ir savienoti viens ar otru ar kovalentu vai jonu saiti. Tāpēc elektronu pievienot vai atņemt kļūst daudz grūtāk. Lielākajai daļai molekulu ir sarežģīta arhitektūras struktūra, kur katrs atoms iepriekš ieņem tai piešķirto vietu.

Atoms un molekula: vispārīgās īpašības
Struktūra. Abas daļiņas ir matērijas struktūrvienības. Šajā gadījumā atoms nozīmē vienu konkrētu elementu, savukārt molekulā jau ir vairāki ķīmiski saistīti atomi, bet struktūra (pozitīvs kodols ar negatīviem elektroniem) paliek nemainīga.
Elektriskā neitralitāte. Ja nav ārējo faktoru - mijiedarbības ar citu ķīmisku vielu, virzītu elektrisko lauku un citiem stimuliem - atomiem un molekulām nav lādiņa.
Aizstāšana. Atoms var darboties kā molekula vienā gadījumā – strādājot ar inertajām gāzēm. Monatomisko dzīvsudrabu var uzskatīt arī par molekulu.
Masas pieejamība. Abām daļiņām ir sava atšķirīga masa. Atoma gadījumā masa ir atkarīga no ķīmiskā elementa, un to nosaka kodola svars (protons ir gandrīz 1500 reižu smagāks par elektronu, tāpēc negatīvās daļiņas svars bieži netiek ņemts vērā). Molekulas masu nosaka, pamatojoties uz tās ķīmisko formulu - elementiem, kas veido tās sastāvu.
Atoms un molekula: lieliskas īpašības
Nedalāmība. Atoms ir mazākais elements, no kura nevar izolēt vēl mazāku daļiņu. (Jona iegūšana ietekmē tikai lādiņu, nevis svaru). Molekulu savukārt var sadalīt mazākās molekulās vai sadalīt atomos. Sadalīšanās process ir viegli sasniedzams, izmantojot ķīmiskos katalizatorus. Dažreiz pietiek tikai ar vielas karsēšanu.
Brīva eksistence. Molekula var brīvi eksistēt dabā. Atoms brīvā formā pastāv tikai divos gadījumos:
- Tāpat kā monoatomisks dzīvsudrabs vai inerta gāze.
- Kosmosa apstākļos jebkuri ķīmiskie elementi var pastāvēt kā atsevišķi atomi.
Citos gadījumos atoms vienmēr ir daļa no molekulas.
Uzlādes veidošanās. Kodola un elektrona mijiedarbību atomā var viegli pārvarēt pat ar mazāko elektrisko lauku. Tādējādi no atoma ir viegli iegūt pozitīvu vai negatīvu jonu. Ķīmisko saišu klātbūtne starp atomiem molekulā prasa daudz lielāka elektriskā lauka pielietošanu vai mijiedarbību ar citu ķīmiski aktīvu vielu.
Raksta saturs
MOLEKULU UZBŪVE(molekulārā struktūra), atomu relatīvais izvietojums molekulās. Ķīmisko reakciju laikā reaģentu molekulās atomi pārkārtojas un veidojas jauni savienojumi. Tāpēc viena no fundamentālām ķīmiskajām problēmām ir noskaidrot atomu izvietojumu sākotnējos savienojumos un izmaiņu raksturu, veidojoties no tiem citiem savienojumiem.
Pirmās idejas par molekulu struktūru balstījās uz vielas ķīmiskās uzvedības analīzi. Šīs idejas kļuva sarežģītākas, jo uzkrājās zināšanas par vielu ķīmiskajām īpašībām. Ķīmijas pamatlikumu pielietošana ļāva noteikt atomu skaitu un veidu, kas veido dotā savienojuma molekulu; šī informācija ir ietverta ķīmiskajā formulā. Laika gaitā ķīmiķi saprata, ka ar vienu ķīmisko formulu nepietiek, lai precīzi raksturotu molekulu, jo ir izomēru molekulas, kurām ir vienādas ķīmiskās formulas, bet dažādas īpašības. Šis fakts lika zinātniekiem domāt, ka molekulas atomiem ir jābūt noteiktai topoloģijai, ko stabilizē saites starp tiem. Pirmo reizi šo ideju 1858. gadā izteica vācu ķīmiķis F. Kekule. Pēc viņa idejām, molekulu var attēlot, izmantojot strukturālo formulu, kas norāda ne tikai pašus atomus, bet arī savienojumus starp tiem. Starpatomu saitēm jāatbilst arī atomu telpiskajam izvietojumam. Metāna molekulas uzbūves ideju attīstības stadijas ir parādītas attēlā. 1. Struktūra atbilst mūsdienu datiem G: molekulai ir regulāra tetraedra forma ar oglekļa atomu centrā un ūdeņraža atomiem virsotnēs.
Tomēr šādi pētījumi neko neteica par molekulu lielumu. Šī informācija kļuva pieejama tikai līdz ar atbilstošu fizisko metožu izstrādi. Vissvarīgākais no tiem izrādījās rentgenstaru difrakcija. No rentgenstaru izkliedes modeļiem uz kristāliem kļuva iespējams noteikt precīzu atomu atrašanās vietu kristālā, un molekulārajiem kristāliem bija iespējams lokalizēt atomus atsevišķā molekulā. Citas metodes ietver elektronu difrakciju, kad tie iet cauri gāzēm vai tvaikiem, un molekulu rotācijas spektru analīzi.
Visa šī informācija sniedz tikai vispārīgu priekšstatu par molekulas struktūru. Ķīmisko saišu raksturs ļauj mums izpētīt mūsdienu kvantu teoriju. Un, lai gan molekulāro struktūru vēl nevar aprēķināt ar pietiekami augstu precizitāti, visi zināmie dati par ķīmiskajām saitēm ir izskaidrojami. Ir pat prognozēta jaunu ķīmisko saišu veidu esamība.
Vienkārša kovalentā saite.
Ūdeņraža molekula H2 sastāv no diviem identiskiem atomiem. Pēc fizikālajiem mērījumiem, saites garums - attālums starp ūdeņraža atomu (protonu) kodoliem - ir 0,70 Å (1 Å = 10 -8 cm), kas atbilst ūdeņraža atoma rādiusam pamatstāvoklī, t.i. minimālas enerģijas stāvoklī. Saišu veidošanos starp atomiem var izskaidrot tikai ar pieņēmumu, ka to elektroni ir lokalizēti galvenokārt starp kodoliem, veidojot negatīvi lādētu saistvielu daļiņu mākoni un turot kopā pozitīvi lādētus protonus.
Apskatīsim divus ūdeņraža atomus pamatstāvoklī, t.i. stāvoklis, kurā to elektroni atrodas 1 s- orbitāles. Katru no šiem elektroniem var uzskatīt par vilni un orbitāli kā stāvošu vilni. Atomiem tuvojoties viens otram, orbitāles sāk pārklāties (2. att.), un, tāpat kā parasto viļņu gadījumā, rodas interference - viļņu (viļņu funkciju) superpozīcija pārklāšanās reģionā. Ja viļņu funkciju pazīmes ir pretējas, tad traucējumu laikā viļņi viens otru iznīcina (destruktīvi traucējumi), un, ja tie ir vienādi, tad summējas (konstruktīvi traucējumi). Kad ūdeņraža atomi saplūst kopā, ir iespējami divi iznākumi atkarībā no tā, vai viļņu funkcijas ir fāzē (2. att., A) vai pretfāzē (2. att., b). Pirmajā gadījumā radīsies konstruktīvi traucējumi, otrajā - destruktīvi traucējumi, un parādīsies divas molekulārās orbitāles; vienam no tiem raksturīgs augsts blīvums reģionā starp kodoliem (2. att., V), otram – zems (2. att., G) faktiski ir mezgls ar nulles amplitūdu, kas atdala kodolus.
Tādējādi, kad ūdeņraža atomi tuvojas un mijiedarbojas 1 s-orbitāles veido divas molekulārās orbitāles, un diviem elektroniem ir jāaizpilda viena no tām. Elektroni atomos vienmēr cenšas ieņemt visstabilāko pozīciju - to, kurā viņu enerģija ir minimāla. Attēlā parādītajai orbitālei. 2, V, apgabalā starp kodoliem ir augsts blīvums, un katrs elektrons, kas aizņem šo orbitāli, lielākoties atradīsies pozitīvi lādētu kodolu tuvumā, t.i. tā potenciālā enerģija būs maza. Gluži pretēji, orbitāle, kas parādīta attēlā. 2, G, maksimālais blīvums rodas reģionos, kas atrodas pa kreisi un pa labi no kodoliem, un šajā orbitālē esošo elektronu enerģija būs augsta. Tātad elektroniem ir mazāk enerģijas, kad tie aizņem orbitāli V, un šī enerģija ir pat mazāka par to, kas viņiem būtu, ja atomi būtu bezgalīgi tālu viens no otra. Tā kā šajā gadījumā ir tikai divi elektroni, abi var ieņemt enerģētiski labvēlīgāku orbitāli, ja to spini ir pretparalēli (Pauli princips). Tāpēc sistēmas enerģija, kas sastāv no diviem ūdeņraža atomiem, samazinās, atomiem tuvojoties viens otram, un, lai pēc tam atdalītu atomus vienu no otra, būs nepieciešama enerģija, kas vienāda ar stabilas ūdeņraža molekulas H2 veidošanās enerģiju. Ņemiet vērā, ka nepieciešams nosacījums ūdeņraža molekulas pastāvēšanai ir preferenciāla elektronu lokalizācija starp kodoliem saskaņā ar to, ko mēs jau teicām iepriekš. Molekulārā orbitāle V sauc par savienojošo orbitāli un orbitāli G- atslābināšana.
Tagad aplūkosim divu hēlija atomu (atomskaitlis 2) pieeju. Arī šeit ir pārklāšanās 1 s-orbitāles noved pie divu molekulāro orbitāļu veidošanās, no kurām viena atbilst zemākai, bet otrai augstākai enerģijai. Taču šoreiz orbitālēs jāievieto 4 elektroni, 2 elektroni no katra hēlija atoma. Zemas enerģijas savienojuma orbitāli var aizpildīt tikai divi no tiem, pārējām divām ir jāieņem augstas enerģijas orbitāle G. Enerģijas samazinājums pirmā pāra labvēlīgās atrašanās vietas dēļ ir aptuveni vienāds ar enerģijas pieaugumu otrā pāra nelabvēlīgās atrašanās vietas dēļ. Tagad atomu tuvināšana nesniedz nekādu enerģijas pieaugumu, un neveidojas molekulārais hēlijs He 2. To var ērti ilustrēt, izmantojot diagrammu (3. att.); dažādās orbitāles uz tā ir attēlotas kā enerģijas līmeņi, kuros var atrasties elektroni. Pēdējie ir norādīti ar bultiņām, kas vērstas uz augšu un uz leju, lai atšķirtu griešanās virzienu. Divi elektroni var aizņemt vienu orbitāli tikai tad, ja to spini ir pretparalēli.
Šie vispārīgie principi tiek ievēroti, veidojot molekulas no atomiem. Tiklīdz divi atomi nonāk tik tuvu, ka to atomu orbitāles (AO) sāk pārklāties, parādās divas molekulārās orbitāles (MO): viena savieno, otra antisaite. Ja katram AO ir tikai viens elektrons, tie abi var aizņemt savienojošo MO ar mazāku enerģiju nekā AO un veidot ķīmisku saiti. Šāda veida saites, ko tagad sauc par kovalentajām, ķīmiķiem bija zināmas jau sen (ideja par kovalento saiti veidoja pamatu okteta savienojuma teorijai, ko 1916. gadā formulēja amerikāņu fizikālis ķīmiķis Dž. Lūiss). To veidošanās tika izskaidrota ar elektronu pāra koplietošanu, mijiedarbojoties atomiem. Saskaņā ar mūsdienu koncepcijām saites stiprums ir atkarīgs no atbilstošo orbitāļu pārklāšanās pakāpes. Viss iepriekš minētais liecina, ka saites starp atomiem var veidoties, daloties ne tikai diviem, bet arī vienam vai trim elektroniem. Tomēr tās būs vājākas par parastajām kovalentajām saitēm šādu iemeslu dēļ. Veidojot viena elektrona saiti, samazinās tikai viena elektrona enerģija, savukārt, ja saite veidojas trīs elektronu koplietošanas rezultātā, divu no tiem enerģija samazinās, bet trešā, gluži pretēji. , palielinās, kompensējot enerģijas samazināšanos vienam no pirmajiem diviem elektroniem. Rezultātā iegūtā trīs elektronu saite izrādās divreiz vājāka par parasto kovalento saiti.
Viena un trīs elektronu koplietošana notiek attiecīgi molekulārā ūdeņraža jona H 2 + un HHe molekulas veidošanās laikā. Parasti šāda veida saites ir reti sastopamas, un atbilstošās molekulas ir ļoti reaģējošas.
Valence. Donoru-akceptoru obligācijas.
Viss iepriekš minētais paredz, ka atomi var izveidot tik daudz kovalento saišu, cik to orbitāles aizņem viens elektrons, taču tas ne vienmēr notiek. [Pieņemtajā AO aizpildīšanas shēmā vispirms norāda apvalka numuru, pēc tam orbitāles veidu un pēc tam, ja orbitālē ir vairāk nekā viens elektrons, to numuru (augšraksts). Tātad, ierakstiet (2 s) 2 nozīmē, ka ieslēgts s-otrā apvalka orbitāles satur divus elektronus.] Oglekļa atoms pamatstāvoklī (3 R) ir elektroniska konfigurācija (1 s) 2 (2s) 2 (2lpp x)(2 lpp y), kamēr divas orbitāles nav aizpildītas, t.i. satur pa vienam elektronam. Tomēr divvērtīgie oglekļa savienojumi ir ļoti reti sastopami un ir ļoti reaģējoši. Parasti ogleklis ir četrvērtīgs, un tas ir saistīts ar faktu, ka tā pārejai uz ierosinātu 5 S- valsts (1 s) 2 (2s) (2lpp x)(2 lpp y)(2 lpp z) Ar četrām neaizpildītām orbitālēm ir nepieciešams ļoti maz enerģijas. Ar pāreju saistītās enerģijas izmaksas 2 s-elektronu uz brīvo 2 R-orbitālas, vairāk nekā kompensē enerģija, kas izdalās divu papildu saišu veidošanās laikā. Neaizpildīto AO veidošanai ir nepieciešams, lai šis process būtu enerģētiski labvēlīgs. Slāpekļa atoms ar elektronu konfigurāciju (1 s) 2 (2s) 2 (2lpp x)(2 lpp y)(2 lpp z) neveido piecvērtīgus savienojumus, jo enerģija, kas nepieciešama 2 pārnešanai s- elektrons 3 d-orbitāla, lai izveidotu piecvērtīgu konfigurāciju (1 s) 2 (2s)(2lpp x)(2 lpp y)(2 lpp z)(3 d), ir pārāk liels. Līdzīgi bora atomi ar parasto konfigurāciju (1 s) 2 (2s) 2 (2lpp) ierosinātā stāvoklī var veidot trīsvērtīgus savienojumus (1 s) 2 (2s)(2lpp x)(2 lpp y), kas notiek 2. pārejas laikā s- elektrons 2 R-AO, bet neveido piecvērtīgus savienojumus kopš pārejas uz ierosināto stāvokli (1 s)(2s)(2lpp x)(2 lpp y)(2 lpp z), sakarā ar viena no 1 nodošanu s-elektronu uz augstāku līmeni prasa pārāk daudz enerģijas. Atomu mijiedarbība ar saites veidošanos starp tiem notiek tikai orbitāļu klātbūtnē ar tuvām enerģijām, t.i. orbitāles ar vienādu galveno kvantu skaitli. Attiecīgie dati par pirmajiem 10 periodiskās tabulas elementiem ir apkopoti zemāk. Atoma valences stāvoklis ir stāvoklis, kurā tas veido ķīmiskās saites, piemēram, 5. stāvoklis Sčetrvērtīgajam ogleklim.
| VALANCES STĀVOKĻI UN VALENCES PERIODISKĀS TABULAS PIRMIE DESMIT ELEMENTI |
|||
| Elements | Zemes stāvoklis | Normāls valences stāvoklis | Regulāra valence |
| H | (1s) | (1s) | 1 |
| Viņš | (1s) 2 | (1s) 2 | 0 |
| Li | (1s) 2 (2s) | (1s) 2 (2s) | 1 |
| Esi | (1s) 2 (2s) 2 | (1s) 2 (2s)(2lpp) | 2 |
| B | (1s) 2 (2s) 2 (2lpp) | (1s) 2 (2s)(2lpp x)(2 lpp y) | 3 |
| C | (1s) 2 (2s) 2 (2lpp x)(2 lpp y) | (1s) 2 (2s)(2lpp x)(2 lpp y)(2 lpp z) | 4 |
| N | (1s) 2 (2s) 2 (2lpp x)(2 lpp y)(2 lpp z) | (1s) 2 (2s) 2 (2lpp x)(2 lpp y)(2 lpp z) | 3 |
| O | (1s) 2 (2s) 2 (2lpp x) 2 (2 lpp y)(2 lpp z) | (1s) 2 (2s) 2 (2lpp x) 2 (2 lpp y)(2 lpp z) | 2 |
| F | (1s) 2 (2s) 2 (2lpp x) 2 (2 lpp y) 2 (2 lpp z) | (1s) 2 (2s) 2 (2lpp x) 2 (2 lpp y) 2 (2 lpp z) | 1 |
| Ne | (1s) 2 (2s) 2 (2lpp x) 2 (2 lpp y) 2 (2 lpp z) 2 | (1s) 2 (2s) 2 (2lpp x) 2 (2 lpp y) 2 (2 lpp z) 2 | 0 |
Šie modeļi ir redzami šādos piemēros:
Viss iepriekš minētais attiecas tikai uz neitrāliem atomiem. Joniem un atbilstošajiem atomiem ir atšķirīgs elektronu skaits; joniem var būt tāda pati valence kā citiem atomiem ar tādu pašu elektronu skaitu. Tādējādi N + un B – joniem ir tāds pats elektronu skaits (seši) kā neitrālam oglekļa atomam, un attiecīgi tie ir četrvērtīgi. Amonija joni NH 4 + un bora hidrīds BH 4 veido kompleksus sāļus un savā elektroniskajā konfigurācijā ir līdzīgi metānam CH 4.
Tagad pieņemsim, ka amonjaka NH 3 un bora trifluorīda BF 3 molekulas ir tuvinātas viena otrai. Elektronam pārejot no slāpekļa atoma uz bora atomu, mēs iegūstam divus jonus NH 3 + un BF 3 –, katrs ar neaizņemtu orbitāli, kas var izraisīt kovalentās saites veidošanos. H 3 N–BF 3 molekula ir 1,1,1-trifluoretāna H 3 C–CF 3 elektronisks analogs. Saites, kas veidojas starpatomu elektronu pārneses rezultātā, kam seko kovalentās saites veidošanās, sauc par donora-akceptoru.
Molekulu ģeometrija. Hibridizācija.
Visas atomu orbitāles, izņemot s, ir sfēriski asimetriskas, un to pārklāšanās pakāpe ar citu atomu AO ir atkarīga no orbitāļu savstarpējās orientācijas. Tātad, R-AO pārklāsies ar cita atoma AO vislielākajā mērā, ja pēdējais atrodas gar savu asi (4. att., A). Tas nozīmē, ka saitēm, kas veidojas AO pārklāšanās rezultātā, ir jābūt noteiktai ģeometrijai. Apsveriet oglekļa atomu 5 S- stāvoklis. Tajā ir viens elektrons no trim R-orbitāles un ceturtajā, sfēriski simetriskas s- orbitāles. Šķiet, ka trīs saites, ko tas veido, atšķirsies no ceturtās, kamēr R-savienojumi tiks izvietoti savstarpēji perpendikulāros virzienos pa asīm R-AO. Patiesībā tiek novērota cita, pilnīgi simetriska aina. Vienkāršākais veids, kā to izskaidrot, ir šāds. Orbitālais komplekts (2 s)+(2lpp x)+(2 lpp y)+(2 lpp z) ir noteikts “orbitālās telpas” tilpums, kas spēj noturēt četrus elektronu pārus. Mēs varam iegūt līdzvērtīgu šīs situācijas aprakstu, sajaucot visas orbitāles un sadalot to summu četrās vienādās daļās tā, ka katra no iegūtajām jauktajām vai hibrīdajām orbitālēm satur vienu elektronu pāri. Tāpēc 5 S Oglekļa stāvokli var attēlot kā (1 s) 2 (t 1)(t 2)(t 3)(t 4), kur t i– hibrīdas orbitāles, kas veiksmīgi izskaidro simetriskas četrvērtīgas oglekļa molekulas veidošanos. Tagad apsvērsim, kas notiek, sajaucot R-AO s s-AO. Vienas pusītes stiprināšana R-hanteles traucējumus vienmēr pavadīs tās otrās puses vājināšanās (4. att., b), kā rezultātā veidojas asimetriska hibrīda orbitāle (4. att., V). Tas efektīvi pārklājas ar citām orbitālēm, kas orientētas tajā pašā virzienā, veidojot diezgan spēcīgas saites. Tas ir viens no iemesliem, kāpēc oglekļa atoms dod priekšroku saišu veidošanai, izmantojot AO hibridizāciju. Bet ir vēl viens iemesls. Apsveriet tipisku četrvērtīgu oglekļa savienojumu, piemēram, metānu CH4. Tajā katrs ūdeņraža atoms atrodas pie oglekļa atoma ar kopīgu elektronu pāri. Šie pāri atgrūž viens otru, un optimālā molekulas konfigurācija ir tāda, kurā tie atrodas maksimāli iespējamā attālumā viens no otra. Šajā gadījumā ūdeņraža atomi atradīsies regulāra tetraedra virsotnēs, un oglekļa atoms atradīsies tā centrā. Šo ģeometriju var realizēt, izmantojot t.s. sp 3-hibrīda orbitāles, katru veido 1/4 no 2 s-AO un viens no 2 R-AO. Visas šīs orbitāles pēc formas ir identiskas, viegli veido saites un ir vērstas no regulāra tetraedra centrā esošā oglekļa atoma uz tā četrām virsotnēm (1. att., G).
Slāpekļa atoms var veidot saites tikai ar 2 R-AO, starp kuriem leņķi būtu 90°, bet 2. čaulas saistošo elektronu pāru un nesaistošo elektronu pāru savstarpējā atgrūšanās tiek minimizēta, ja saišu veidošanā piedalās “tetraedriskie” sp 3 -orbitāles. Tomēr šeit parādās vēl viena iezīme. N+ jonu konfigurācijai (1 s) 2 (2s)(2lpp) 3 un (1 s) 2 (t) 4 , kur t – sp 3 hibrīdie AO ir patiesi līdzvērtīgi. Vēl viena lieta ir neitrālais slāpekļa atoms, kura 7. elektrons var aizņemt vai nu 2 s-AO, un tad jūs saņemat konfigurāciju (1 s) 2 (2s)(2lpp) 4 vai t-AO konfigurācijā (1 s) 2 (t) 5 . Kopš 2 s-AO atrodas zem 2 lpp-AO un tāpēc zemāks par jebkuru sp-hibrīda orbitāle, pirmā konfigurācija izrādās enerģētiski labvēlīgāka un varētu sagaidīt, ka, ja pārējās lietas ir vienādas, trīsvērtīgais slāpeklis dotu priekšroku “nehibridizētai” konfigurācijai. Tomēr elektronu pāru savstarpējā atgrūšanās acīmredzot ir pietiekama, lai notiktu hibridizācija, kurā saišu leņķi slāpekļa savienojumā, piemēram, amonjakā NH 3, ir tuvi atbilstošajiem leņķiem regulārā tetraedrā, t.i. līdz 109°. Tas pats attiecas uz divvērtīgo skābekli ūdens molekulas H 2 O sastāvā. Visos šajos gadījumos saistītie atomi aizņem trīs (vai divas) tetraedra virsotnes, bet 2. apvalka vientuļo elektronu pāri aizņem pārējās virsotnes.
Līdzīga argumentācija attiecas uz citiem tipiskiem periodiskās tabulas IV, V un VI grupas elementiem. IV grupas tetravalentie elementi (Si, Ge, Sn un Pb) vienmēr veido tetraedriskas struktūras, bet citi V un VI grupas elementi (P, S, As, Se, Sb, Te) atšķiras no slāpekļa un skābekļa un veido savienojumus ar saiti. leņķi, tuvu 90°. Acīmredzot, ņemot vērā šo atomu lielāku izmēru, valences elektronu savstarpējā atgrūšana nav pietiekama, lai nodrošinātu N un O novēroto hibridizāciju.
Obligācijas, kas ietver d-orbitāles.
Atšķirībā no slāpekļa, fosfora atoms var veidot piecas kovalentās saites. Pamatstāvoklī fosforam ir konfigurācija (1 s) 2 (2s) 2 (2lpp) 6 (3s) 2 (3lpp x)(3 lpp y)(3 lpp z) un ir trīsvērtīgs, veidojot, tāpat kā slāpekli, PF 3 tipa savienojumus. Taču šajā gadījumā ir iespējams piedalīties 3 s-elektronus saišu veidošanā, kopš d-AO (3 d) ir vienāds galvenais kvantu skaitlis. Patiešām, ir zināmi arī PF 5 tipa piecvērtīgie fosfora savienojumi, kuros fosfors ir +5 valences stāvoklī, kas atbilst elektroniskajai konfigurācijai (1 s) 2 (2s) 2 (2lpp) 6 (3s)(3lpp x)(3 lpp y)(3 lpp z)(3 d); savienojumi šajā gadījumā veidojas rezultātā sp 3 d-hibridizācija (t.i., sajaucot vienu s-, trīs R- un viens d-AO). Optimāla struktūra no valences elektronu pāru savstarpējās atgrūšanas samazināšanas viedokļa ir trīsstūrveida bipiramīda (5. att. A). Sērs var būt ne tikai divvērtīgs, bet arī četrvērtīgs (SF 4) un sešvērtīgs (SF 6), atrodoties stāvokļos (1 s) 2 (2s) 2 (2lpp) 6 (3s) 2 (3lpp x)(3 lpp y)(3 lpp z)(3 d) un (1 s) 2 (2s) 2 (2lpp) 6 (3s)(3lpp x)(3 lpp y)(3 lpp z)(3 d 1)(3d 2) attiecīgi. Četrvērtīgajos sēra savienojumos 3. čaulas elektronu savstarpējā atgrūšanās tiek optimizēta, hibridizējot visu tā elektronu orbitāļus. Šāda veida savienojumu struktūra ir līdzīga PF 5 struktūrai, bet vienu no trīsstūrveida bipiramīdas virsotnēm aizņem 3. čaulas vientuļo elektronu pāris (5. att. b). Sešvērtīgajos sēra savienojumos elektronu savstarpējā atgrūšanās tiek samazināta līdz minimumam, kad sp 3 d 2 -
hibridizācija, kad visas orbitāles ir līdzvērtīgas un vērstas uz regulāra oktaedra virsotnēm (5. att., V).
Līdz šim mēs esam ņēmuši vērā tikai tos periodiskās tabulas elementus, kuriem ir čaulas ar d-orbitāles ir vai nu pilnībā piepildītas, vai pilnīgi tukšas. Tagad pakavēsimies pie pārejas elementiem, kuros šie apvalki nav pilnībā aizpildīti. Elektronu enerģija dažādās 3. čaulas orbitālēs palielinās šādā secībā: 3 s p d; visas orbitāles ir pārāk tālu no 2. apvalka orbitālēm, lai notiktu hibridizācija. Tajā pašā laikā 3 d- 4. čaulas orbitāles un orbitāles ir enerģētiski pietiekami tuvu, lai būtu iespējama 3. mijiedarbība d-, 4s- un 4 R-orbitāles, un pārejas elementi no Sc uz Cu var veidot kovalentās saites, hibridizējot šīs orbitāles. Visos gadījumos, kad ir divi 3 d-orbitāles, saišu veidošanās notiek caur d 2 sp 3-hibridizācija, savukārt hibrīda orbitāles pēc formas ir līdzīgas sp 3 d 2 -orbitāles. Elementi šāda veida savienojumos ir sešvērtīgi, un pašām savienojumu molekulām ir oktaedra forma (5. att. V). Lielākā daļa no tiem satur jonus, un var uzskatīt, ka tie veidojas, mijiedarbojoties centrālā atoma jonam ar sešām molekulām, no kurām katrā ir vientuļu elektronu pāris. Kovalentās saites ar centrālo jonu sauc par donora-akceptora saitēm. Vienkāršs šāda savienojuma piemērs ir trīsvērtīgā kobalta Co(NH 3) 6 3+ heksamīna jons. Co 3+ jonam ir elektroniska konfigurācija (1 s) 2 (2s) 2 (2lpp) 6 (3s) 2 (3lpp) 6 (3d 1) 2 (3d 2) 2 (3d 3) 2, un trīs no viņa pieciem 3 ir pilnībā aizņemti d-orbitāles, un divas ir 3 d-AO ir bezmaksas. Šīs orbitāles var hibridizēties ar 4 s- un 4 R-AO ar sešu oktaedru veidošanos d 2 sp 3-orbitāles; tās visas ir brīvas un var piedalīties akceptorsaišu veidošanā ar sešām amonjaka molekulām.
Atšķirīga aina tiek novērota, ja centrālajam atomam ir tikai viens brīvs d- orbitāls. Kā piemēru var minēt divkārši lādētu niķeļa jonu Ni 2+, kurā optimālā konfigurācija rodas, veidojot četras saites, izmantojot dsp 2 -orbitāles. Šīs orbitāles atrodas vienā plaknē 90° leņķī viena pret otru.
Vairāki savienojumi.
Viens no labi zināmajiem oglekļa savienojumiem ir etilēns C 2 H 4, kurā katrs oglekļa atoms ir saistīts tikai ar trim citiem atomiem. Pēc analoģijas ar boru mēs varam pieņemt, ka optimālā ģeometrija būs tāda, ka sp 2-hibrīda orbitāles atrodas vienā plaknē. Šajā gadījumā katram oglekļa atomam būs viens neizmantots (in sp 2 - hibridizācija) R-orbitāle, kas satur vienu no četriem valences elektroniem. Ja visi seši etilēna atomi atrodas vienā plaknē, tad divi neizmantoti R-AO pārklājas viens ar otru, kā parādīts attēlā. 6, A. Šī pārklāšanās noved pie MO pāra veidošanās: viena saite (6. att., b) un vienu atslābināšanu (6. att., V). Tā kā tie katrs satur tikai vienu elektronu, tie var veidot zemas enerģijas savienojuma MO. Tas rada papildu saiti starp oglekļa atomiem, un etilēna strukturālajai formulai ir forma
Šis jaunais saišu veids atšķiras no tām, kuras veido orbitāļu pārklāšanās gar atomu savienojuma līniju divos aspektos. Pēdējais saišu veids, C–C atsevišķas saites, ir aksiāli simetriskas, un tāpēc tos neietekmē to grupu rotācija, kuras tās savieno. Gluži pretēji, pārklājas R-orbitāles ir atkarīgas no tā, vai visi seši etilēna molekulas atomi atrodas vienā plaknē, jo optimālai pārklāšanai R-AO jābūt paralēlam. Tādējādi, lai gan rotācija ap vienu C-C saiti var notikt salīdzinoši brīvi, rotācija ap dubulto C = C saiti ir ļoti sarežģīta. Patiešām, etilēna molekula ir stingra, plakana struktūra. Otrā atšķirība attiecas uz orbītas pārklāšanās pakāpi. Krusta pārklāšanās R-AO ir salīdzinoši neefektīvs, un tāpēc šāda veida savienojums ir vājš. Tāpēc etilēns ir ķīmiski aktīvāks nekā piesātinātie savienojumi, kuriem ir tikai atsevišķas saites.
S-saites un ar šķērsvirziena pārklāšanos - lpp- savienojumi.
Dažu savienojumu, piemēram, acetilēna C 2 H 2, molekulās ir trīskāršās saites. Tajos katrs oglekļa atoms ir savienots ar savu kaimiņu s- izveidoti savienojumi sp-hibrīdās orbitāles. Tie ir kolineāri, tāpēc četri atomi acetilēna molekulā atrodas uz vienas taisnas līnijas. Atpūta R-AO oglekļa atomi, pārklājoties, veido divus lpp- savienojumi.
Aromātiskie savienojumi.
Benzola molekula C 6 H 6 ir attēlota kā sešu locekļu oglekļa atomu gredzens, no kuriem katram ir pievienots arī ūdeņraža atoms (7. att. A). Tā kā katram oglekļa atomam ir trīs kaimiņi, var pieņemt, ka rezultātā veidojas atbilstošās saites sp 2-hibridizācija un atrodas vienā plaknē 120° leņķī viens pret otru. Patiešām, benzola molekula ir plakana struktūra. Nelietots R-Var veidoties AO oglekļa atomi lpp-savienojumi (7. att., b), tomēr benzolam situācija izrādās sarežģītāka nekā iepriekš aplūkotajos gadījumos, kad saites veidojās AO pāru pārklāšanās rezultātā. benzolā 2 R-Katra oglekļa atoma AO vienlīdz efektīvi jāpārklājas ar 2 R-AO no visiem blakus esošajiem atomiem. (Šeit mēs varam izdarīt analoģiju ar daudzkārtēju viļņu interferenci, salīdzinot orbitāļu pārklāšanos benzola molekulā ar viļņu pārklāšanos, kas izkliedēti ar diviem spraugām vai uz difrakcijas režģa.) Rezultātā benzolam mēs iegūstam gredzenu kopu molekulārās orbitāles, kas aptver visus sešus oglekļa atomus (7. att., V). Sistēmas kopējā enerģija ar šādu elektronu konfigurāciju ir mazāka nekā tad, ja R-AO veidoja parastos pa pāriem lpp- savienojumi. Patiešām, benzols ir stabilāks un mazāk aktīvs, nekā varētu gaidīt, pamatojoties uz tā “klasisko” struktūru (7. att., G). Visas saites tās molekulā ir simetriskas, un to garums ir vienāds, un stiprības ziņā tās ieņem starpstāvokli starp vienkāršām un dubultām saitēm. Ir zināmi arī citi savienojumi, kuros lpp-elektroni piedalās “daudzcentru” MO veidošanā un kuriem novērojamas līdzīgas saišu garuma un ķīmiskās aktivitātes pazīmes. 
Savienojumi, kas satur daudzcentru saites.
Pat tādās vienkāršās molekulās kā CH 4 atsevišķas molekulārās orbitāles noteikti mijiedarbojas viena ar otru. Tāpēc ideju par lokalizētajām divu centru kovalentajām saitēm var uzskatīt tikai par noteiktu tuvinājumu. Tomēr parasti šīs mijiedarbības ir vājas, jo orbītas pārklāšanās pakāpe ir neliela (izņemot lpp-MO aromātiskajos un līdzīgos savienojumos). Tomēr mēs nevaram izslēgt molekulu esamību ar vairākiem pārklājošiem AO, kas ir atbildīgi par saišu veidošanos, dalot elektronus ar trim vai vairākiem atomiem. Piemērs ir diborāns B 2 H 6, kam ir seši valences elektronu pāri; ar to nepietiek, lai izveidotu septiņas saites, kas nepieciešamas klasiskās H 3 B–BH 3 struktūras izveidošanai. H. Longuets-Higinss ierosināja diborāna struktūru, kas parādīta attēlā. 8, A. Šajā struktūrā centrālie ūdeņraža atomi ir savienoti ar trīscentru saitēm, kas veidojas pārklāšanās rezultātā sp 3-hibrīdas divu bora atomu orbitāles ar 1 s-ūdeņraža atoma AO (8. att., b). Četri no sešiem valences elektronu pāriem piedalās parasto veidošanā s-saites ar “gala” ūdeņraža atomiem un diviem trīscentru saišu pāriem. Sarežģītāks daudzcentru saites piemērs ir dibenzola hroma molekula (8. att., V). Šīs molekulas benzola gredzeni ir savienoti ar metāla atomu ar sarežģītām daudzcentru orbitālēm, kas veidojas, pārklājoties lpp-Benzols MO ar 3 d-, 4s- un 4 R- centrālā atoma AO. Ir zināmi arī citi līdzīgi savienojumi, kuriem ir sendvičtipa struktūra. 
Izredzes.
Šobrīd vispārīgos molekulu struktūras principus var uzskatīt par izveidotiem. Ir izstrādātas fizikāli ķīmiskās metodes sarežģītu molekulu, tajā skaitā bioloģisko, struktūras noteikšanai. Tuvākajā nākotnē ir iespējams virzīties uz priekšu divos saistītos virzienos. Mums vajadzētu sagaidīt, pirmkārt, kvantu mehānisko aprēķinu precizitātes pieaugumu un, otrkārt, attiecīgo molekulāro parametru mērīšanas eksperimentālo metožu uzlabošanos.
Saskaņā ar mūsdienu idejām:
Atom ir elektriski neitrāla daļiņa, kas sastāv no pozitīvi lādēta kodola un negatīvi lādētiem elektroniem.
Nav pareizi teikt, ka "atoms ir ķīmiskā elementa mazākā daļiņa, kas saglabā visas savas ķīmiskās īpašības", jo ķīmiskais elements – tas ir daļiņu veids (atomi, joni, kodoli) ar noteiktu kodollādiņu; tāpēc elements nav izgatavots no atomiem!
Turklāt ķīmiskās īpašības ir ķīmiskās reakcijas enerģija un ātrums, un tās ir atkarīgas ne tikai no reaģējošās daļiņas sastāva, bet arī no tās enerģētiskā stāvokļa, ģeometriskās formas utt., tāpēc tas nav atomi (un molekulas) kurām piemīt ķīmiskās īpašības, bet to kopums ir ķīmiskas vielas.
Molekula - tas ir elektriski neitrāls mazākais atomu kopums, kas ar ķīmisko saišu palīdzību veido noteiktu struktūru, kas nosaka vielas sastāvu.
Saskaņā ar mūsdienu koncepcijām vielas gāzes un tvaika stāvoklī sastāv no molekulām. Cietā stāvoklī tikai vielas, kuru kristāliskā režģī ir molekulārā struktūra(lielākā daļa organisko vielu; nemetāli, izņemot boru, silīciju, oglekļa alotropās modifikācijas; oglekļa dioksīds CO 2; ūdens H 2 O).
Lielākajai daļai cieto neorganisko vielu nav molekulārās struktūras: to režģis nesastāv no molekulām, bet no citām daļiņām (joniem, atomiem); tie pastāv makroķermeņu veidā (NaCl kristāls, kvarca drūza, dzelzs gabals utt.). Vielas, kurām nav molekulārās struktūras, ir sāļi, metālu oksīdi, dimants, silīcijs, metāli utt.
Ķīmiskā saite starp vielu molekulām ar molekulāro struktūru ir mazāk spēcīga nekā starp molekulā esošajiem atomiem, tāpēc to kušanas un viršanas temperatūra ir salīdzinoši zema. Vielām ar nemolekulāru struktūru starp daļiņām ir ļoti spēcīgas ķīmiskās saites, tāpēc to kušanas un viršanas temperatūra ir augsta.
1.3.2. Atomu un molekulu masas. Kurmis
Atomu un molekulu masas ir ārkārtīgi mazas, tāpēc tām tiek izmantota īpaša mērvienība - atomu masas vienība (saīsināti kā "a.u.m."):
1 a. e.m = 1,66·10 –27 kg.
Piemēram, alumīnija atoma absolūtā masa ir:
m o (Al) = 4,482·10 –26 kg = 27 a. ēst.
Biežāk lietots bezizmēra daudzumus– relatīvās atomu un molekulmasas.
Relatīvā atommasa A r – skaitlis, kas parāda, cik reižu konkrētā atoma masa ir lielāka par 1/12 no 12 C oglekļa atoma masas.
Piemēram:
A r (Al) = = 27.
Relatīvā molekulmasa M r – skaitlis, kas parāda, cik reižu dotās molekulas masa ir lielāka par 1/12 no 12 C oglekļa atoma masas.
Piemēram:
M r (SO 2) =  = 64.
= 64.
Kopā ar masas un tilpuma vienībām ķīmijā viņi izmanto arī vielas daudzuma vienību, ko sauc par molu (saīsināti “mols”).
Kurmis - tas ir vielas daudzums, kas satur tikpat daudz strukturālo vienību (atomu, molekulu, jonu, kodolu, elektronu, radikāļu), cik atomi ir 0,012 kg (12 g) oglekļa 12 C.
Viens mols jebkuras vielas satur Avogadro numurs struktūrvienības, proti
N A = 6,02·10 23 mol –1.
Vielas molam ir noteikta masa (molmasa) un noteikts tilpums (mol tilpums).
Molārā (mol) masa M ir 1 mola vielas masa, kas izteikta masas vienībās:
M(Al) = 27 g/mol; M(H2SO4) = 98 g/mol.
Molārais (molārais) tilpums V m – 1 mola vielas tilpums, izteikts tilpuma vienībās:
V m (CO 2) = 22,4 l/mol (n.s.) 1; V m (H 2 O) = 18 ml/mol.
Piemērs 1.1 . Vjetnamas kara laikā (1962–1971) amerikāņu karaspēks plaši izmantoja defoliantus, lai cīnītos pret nemierniekiem. Defoliants "apelsīns" (oranžais reaģents) izraisa koku lapu paātrinātu zudumu. Kopumā virs džungļiem tika izsmidzināti 57 tūkstoši tonnu šīs narkotikas, kurās kā piemaisījums bija līdz 170 kg dioksīna. Tagad šis defoliants ir pazīstams kā 2,4-D (2,4-dihlorfenoetiķskābe). Aprēķiniet vienas defolianta molekulas masu (molekulārā formula C 8 H 6 O 3 Cl 2): a) gramos; b) atomu masas vienībās.
Risinājums:
A). Lai aprēķinātu 2,4-dihlorfenoetiķskābes molekulas masu, jums jāzina tās molārā masa:
M(C8H6O3Cl2) = 8 12 + 6 1 + 3 16 + 2 35,5 = 221 (g/mol).
Mēs aprēķinām vielas daudzumu, izmantojot šādas formulas:
ν = m/M; ν = N/NA,
kur m ir masa, M ir molārā masa, N ir atomu vai molekulu skaits, N A = 6,02·10 23 mol –1 ir Avogadro konstante.
Apvienojot šīs formulas, mēs varam izteikt masu molekulu skaita izteiksmē:
m = ν · M =  .
.
Iegūtajā formulā aizstājot N = 1, M = 221 g/mol, N A, mēs atrodam:
m(C 8 H 6 O 3 Cl 2) =  = 36,7·10 –23 (g).
= 36,7·10 –23 (g).
b). Molekulas absolūtā masa ir vienāda ar relatīvo molekulmasu, kas reizināta ar 1 a. ēst.
m(C8H6O3Cl2) = 1 a. u.m. M r (C8H6O3Cl2)
Relatīvā molekulmasa ir skaitliski vienāda ar molāro masu:
Mr (C8H6O3Cl2) = 221;
m(C8H6O3Cl2) = 1 a. e.m. · 221 = 221:00 ēst.
Piemērs 1.2. Cik molekulu ir 1 litrā ūdens?
Risinājums. 1. Masa 1 l ūdeni var aprēķināt, izmantojot blīvuma vērtību (ūdens blīvums 4C temperatūrā ir 1 g/cm3):
m(H2O) = V(H2O) ρ(H2O);
V(H 2 O) = 1 l = 1 dm 3 = 1000 cm 3;
m(H 2 O) = 1000 cm 3 1 g/cm 3 = 1000 g.
2. Papildu argumentāciju var veikt divējādi.
1. metode: pēc vielas daudzuma.
Izmantojot formulas ν = m / M un ν = N / N A, mēs atrodam:
ν(H2O) = m(H2O)/M(H2O); ν(H 2 O) = 1000 g / 18 g/mol = 55,6 mol.
N(H2O) = ν(H2O)NA; N(H2O) = 55,6 mol 6,02 10 23 mol –1 = 334,7 10 23 = 3,35 10 25.
2. metode: proporciju izmantošana.
18 g (1 mol) H 2 O satur 6,02 · 10 23 molekulas;
1000 g H 2 O satur N molekulas.
N(H2O) = 1000 6,02 10 23/18 = 3,35 10 25.
Piemērs 1.3. Aprēķiniet alumīnija molāro tilpumu, ja tā blīvums ir 2,7 g/cm3.
Risinājums. Lai aprēķinātu molāro tilpumu pēc vielas blīvuma, jums jāzina tās molārā masa:
ρ(Al) =  ;V m (Al) =
;V m (Al) =  .
.
V m (Al) =  = 10 cm 3 /mol = 0,01 l/mol.
= 10 cm 3 /mol = 0,01 l/mol.
Visi ķermeņi, kas mūs ieskauj, ir izgatavoti no atomiem. Savukārt atomi saliek molekulā. Pateicoties molekulārās struktūras atšķirībai, mēs varam runāt par vielām, kas atšķiras viena no otras, pamatojoties uz to īpašībām un parametriem. Molekulas un atomi vienmēr atrodas dinamikas stāvoklī. Kustības laikā tie joprojām neizkliedējas dažādos virzienos, bet tiek turēti noteiktā struktūrā, par ko mēs esam parādījuši tik milzīgu vielu daudzveidību visā pasaulē. Kas ir šīs daļiņas un kādas ir to īpašības?
Vispārīgi jēdzieni
Ja mēs sākam no kvantu mehānikas teorijas, tad molekula sastāv nevis no atomiem, bet gan no to kodoliem un elektroniem, kas pastāvīgi mijiedarbojas savā starpā.
Dažām vielām molekula ir mazākā daļiņa, kurai ir pašas vielas sastāvs un ķīmiskās īpašības. Tādējādi molekulu īpašības no ķīmijas viedokļa nosaka to sastāvs. Bet tikai uz vielām ar molekulāro struktūru attiecas noteikums: ķīmiskās vielas un molekulas ir vienādas. Dažiem polimēriem, piemēram, etilēnam un polietilēnam, sastāvs neatbilst molekulārajam sastāvam.
Zināms, ka molekulu īpašības nosaka ne tikai atomu skaits un to veids, bet arī savienojuma konfigurācija un secība. Molekula ir sarežģīta arhitektūras struktūra, kurā katrs elements atrodas savā vietā un tam ir savi specifiski kaimiņi. Atomu struktūra var būt vairāk vai mazāk stingra. Katrs atoms vibrē ap savu līdzsvara stāvokli.
Konfigurācija un parametri
Gadās, ka dažas molekulas daļas rotē attiecībā pret citām daļām. Tādējādi termiskās kustības procesā brīva molekula iegūst dīvainas formas (konfigurācijas).
Pamatā molekulu īpašības nosaka saite (tās veids) starp atomiem un pašas molekulas arhitektūra (struktūra, forma). Tātad, pirmkārt, vispārējā ķīmiskā teorija aplūko ķīmiskās saites un balstās uz atomu īpašībām.
Ar spēcīgu polaritāti molekulu īpašības ir grūti aprakstīt ar divu vai trīs konstantu korelācijām, kas ir lieliski piemērotas nepolārajām molekulām. Tāpēc tika ieviests papildu parametrs ar dipola momentu. Bet šī metode ne vienmēr ir veiksmīga, jo polārajām molekulām ir individuālas īpašības. Ir ierosināti arī parametri, lai ņemtu vērā kvantu efektus, kas ir svarīgi zemā temperatūrā.

Ko mēs zinām par visizplatītākās vielas molekulu uz Zemes?
No visām vielām uz mūsu planētas visizplatītākā ir ūdens. Tas burtiski nodrošina dzīvību visam uz Zemes. Bez tā var iztikt tikai vīrusi, pārējās dzīvās struktūras pārsvarā satur ūdeni. Kādas ūdens molekulas īpašības, kas raksturīgas tikai tai, tiek izmantotas cilvēka saimnieciskajā dzīvē un Zemes dzīvajā dabā?
Šī patiešām ir unikāla viela! Neviena cita viela nevar lepoties ar ūdenim raksturīgo īpašību kopumu.
Ūdens ir galvenais šķīdinātājs dabā. Visas dzīvajos organismos notiekošās reakcijas vienā vai otrā veidā notiek ūdens vidē. Tas nozīmē, ka vielas reaģē izšķīdušā stāvoklī.
Ūdenim ir lieliska siltumietilpība, bet zema siltumvadītspēja. Pateicoties šīm īpašībām, mēs to varam izmantot siltuma transportēšanai. Šis princips ir iekļauts liela skaita organismu dzesēšanas mehānismā. Kodolenerģētikā ūdens molekulas īpašības izraisīja šīs vielas izmantošanu kā dzesēšanas šķidrumu. Papildus spējai būt par reaktīvu vidi citām vielām, ūdens pats var iesaistīties reakcijās: fotolīzē, hidratācijā un citās.

Dabīgs tīrs ūdens ir šķidrums, kas ir bez smaržas, bezkrāsas un bez garšas. Bet, ja slāņa biezums ir lielāks par 2 metriem, krāsa kļūst zilgana.
Visa ūdens molekula ir dipols (divi pretēji poli). Tā ir dipola struktūra, kas galvenokārt nosaka šīs vielas neparastās īpašības. Ūdens molekula ir diamagnētiska.
Kausējam ūdenim ir vēl viena interesanta īpašība: tā molekula iegūst zelta griezuma struktūru, bet vielas struktūra iegūst zelta griezuma proporcijas. Daudzas ūdens molekulai piemītošās īpašības ir noteiktas, analizējot absorbcijas un emisijas joslu spektrus gāzes fāzē.
Dabas vēsture un molekulārās īpašības
Visām vielām, izņemot ķīmiskās, ir to struktūrā iekļauto molekulu fizikālās īpašības.
Fizikālajā zinātnē molekulu jēdzienu izmanto, lai izskaidrotu cietvielu, šķidrumu un gāzu īpašības. Visu vielu spēju izkliedēties, to viskozitāti, siltumvadītspēju un citas īpašības nosaka molekulu kustīgums. Kad franču fiziķis Žans Perins pētīja Brauna kustību, viņš eksperimentāli pierādīja molekulu esamību. Visi dzīvie organismi pastāv smalki līdzsvarotas iekšējās mijiedarbības dēļ struktūrā. Visām vielu ķīmiskajām un fizikālajām īpašībām dabaszinātnēs ir būtiska nozīme. Fizikas, ķīmijas, bioloģijas un molekulārās fizikas attīstība radīja molekulārās bioloģijas zinātni, kas pēta dzīves pamatparādības.
Izmantojot statistisko termodinamiku, molekulu fizikālās īpašības, kuras nosaka ar molekulārās spektroskopijas metodēm, fizikālajā ķīmijā tās nosaka ķīmisko līdzsvaru un tā izveidošanās ātrumu aprēķināšanai nepieciešamās vielas.

Kā atomu un molekulu īpašības atšķiras viena no otras?
Pirmkārt, atomi nerodas brīvā stāvoklī.
Molekulām ir bagātāks optiskais spektrs. Tas ir saistīts ar sistēmas zemāku simetriju un jaunu kodolu rotāciju un svārstību iespējamību. Molekulai kopējā enerģija sastāv no trim enerģijām, kas atšķiras pēc komponentu lieluma:
- elektroniskais apvalks (optiskais vai ultravioletais starojums);
- kodola vibrācijas (infrasarkanā spektra daļa);
- molekulas rotācija kopumā (radiofrekvenču diapazons).
Atomi izstaro raksturīgas emisijas, un molekulas izstaro svītras, kas sastāv no daudzām cieši izvietotām līnijām.
Spektrālā analīze
Molekulas optiskās, elektriskās, magnētiskās un citas īpašības nosaka arī savienojums ar Datus par molekulu stāvokļiem un iespējamo pāreju starp tiem parāda molekulu spektri.
Pārejas (elektroniskās) molekulās parāda ķīmiskās saites un to elektronisko apvalku struktūru. Spektriem ar lielāku saišu skaitu ir garo viļņu absorbcijas joslas, kas atrodas redzamajā zonā. Ja viela sastāv no šādām molekulām, tai ir raksturīga krāsa. Tas ir viss
Vienas un tās pašas vielas molekulu īpašības ir vienādas visos agregācijas stāvokļos. Tas nozīmē, ka tām pašām vielām šķidro un gāzveida vielu molekulu īpašības neatšķiras no cietvielu īpašībām. Vienas vielas molekulai vienmēr ir vienāda struktūra neatkarīgi no pašas vielas agregācijas stāvokļa.

Elektriskās īpašības
To, kā viela uzvedas elektriskajā laukā, nosaka molekulu elektriskie raksturlielumi: polarizējamība un pastāvīgais dipola moments.
Dipola moments ir molekulas elektriskā asimetrija. Molekulām, kurām ir simetrijas centrs, piemēram, H2, nav pastāvīga dipola momenta. Molekulas elektronu apvalka spēja kustēties elektriskā lauka ietekmē, kā rezultātā tajā veidojas inducētais dipola moments, ir polarizējamība. Lai atrastu polarizējamības un dipola momenta vērtību, nepieciešams izmērīt dielektrisko konstanti.
Gaismas viļņa uzvedību mainīgā elektriskā laukā raksturo vielas optiskās īpašības, kuras nosaka šīs vielas molekulas polarizējamība. Ar polarizējamību tieši saistītas ir: izkliede, refrakcija, optiskā aktivitāte un citas molekulārās optikas parādības.
Bieži var dzirdēt jautājumu: "No kā, izņemot molekulas, ir atkarīgas vielas īpašības?" Atbilde ir pavisam vienkārša.
Vielu īpašības papildus izometrijai un kristāliskajai struktūrai nosaka vides temperatūra, pati viela, spiediens un piemaisījumu klātbūtne.

Molekulu ķīmija
Pirms kvantu mehānikas zinātnes veidošanās ķīmisko saišu raksturs molekulās bija neatrisināts noslēpums. Klasiskā fizika nevarēja izskaidrot valences saišu virzienu un piesātinājumu. Pēc teorētiskās pamatinformācijas izveides par ķīmiskajām saitēm (1927), izmantojot vienkāršākās molekulas H2 piemēru, teorija un aprēķinu metodes sāka pakāpeniski pilnveidoties. Piemēram, pamatojoties uz plašo molekulārās orbitālās metodes un kvantu ķīmijas izmantošanu, radās iespēja aprēķināt starpatomiskos attālumus, molekulu un ķīmisko saišu enerģiju, elektronu blīvuma sadalījumu un citus datus, kas pilnībā sakrita ar eksperimentālajiem.
Vielas ar vienādu sastāvu, bet atšķirīgu ķīmisko struktūru un atšķirīgām īpašībām sauc par strukturāliem izomēriem. Viņiem ir dažādas strukturālās formulas, bet vienādas molekulārās formulas.
Ir zināmi dažādi strukturālās izomērijas veidi. Atšķirības slēpjas oglekļa skeleta struktūrā, funkcionālās grupas pozīcijā vai daudzkārtējās saites pozīcijā. Turklāt joprojām pastāv telpiskie izomēri, kuros vielas molekulas īpašības raksturo vienāds sastāvs un ķīmiskā struktūra. Tāpēc gan to strukturālās, gan molekulārās formulas ir vienādas. Atšķirības slēpjas molekulas telpiskajā formā. Lai attēlotu dažādus telpiskos izomērus, tiek izmantotas īpašas formulas.
Ir savienojumi, kurus sauc par homologiem. Tiem ir līdzīga struktūra un īpašības, bet sastāvs atšķiras ar vienu vai vairākām CH2 grupām. Visas vielas, kurām ir līdzīga struktūra un īpašības, ir apvienotas homologās sērijās. Izpētījis viena homologa īpašības, jūs varat runāt par jebkuru citu no tiem. Homologu kopa ir homoloģiska sērija.
Kad vielas struktūras tiek pārveidotas, molekulu ķīmiskās īpašības krasi mainās. Pat visvienkāršākie savienojumi kalpo kā piemērs: metāns, savienojoties kaut vai ar vienu skābekļa atomu, kļūst par toksisku šķidrumu, ko sauc par metanolu (metilspirtu - CH3OH). Attiecīgi tā ķīmiskā komplementaritāte un ietekme uz dzīviem organismiem kļūst atšķirīga. Līdzīgas, bet sarežģītākas izmaiņas notiek, mainot biomolekulu struktūras.
Ķīmiskās molekulārās īpašības lielā mērā ir atkarīgas no molekulu struktūras un īpašībām: no tās un pašas molekulas ģeometrijas. Tas jo īpaši darbojas bioloģiski aktīvos savienojumos. Kura konkurējošā reakcija būs dominējošā, bieži vien nosaka tikai telpiskie faktori, kas savukārt ir atkarīgi no sākotnējām molekulām (to konfigurācijas). Viena molekula ar “neērtu” konfigurāciju vispār nereaģēs, savukārt cita, ar tādu pašu ķīmisko sastāvu, bet atšķirīgu ģeometriju, var reaģēt uzreiz.
Liels skaits augšanas un vairošanās laikā novēroto bioloģisko procesu ir saistīti ar ģeometriskām attiecībām starp reakcijas produktiem un izejvielām. Jūsu zināšanai: ievērojama skaita jaunu zāļu iedarbības pamatā ir kāda savienojuma līdzīga molekulārā struktūra, kas no bioloģiskā viedokļa ir kaitīga cilvēka ķermenim. Zāles ieņem kaitīgās molekulas vietu un apgrūtina darbību.
Ķīmiskās formulas izmanto, lai izteiktu dažādu vielu molekulu sastāvu un īpašības. Pamatojoties uz molekulmasu, tiek noteikta atomu attiecība un sastādīta empīriskā formula.
Ģeometrija
Molekulas ģeometrisko struktūru nosaka, ņemot vērā atomu kodolu līdzsvara izvietojumu. Atomu mijiedarbības enerģija ir atkarīga no attāluma starp atomu kodoliem. Ļoti lielos attālumos šī enerģija ir nulle. Kad atomi tuvojas viens otram, sāk veidoties ķīmiskā saite. Tad atomi tiek spēcīgi piesaistīti viens otram.
Ja tiek novērota vāja pievilcība, tad ķīmiskās saites veidošana nav nepieciešama. Ja atomi sāk tuvoties tuvākiem attālumiem, starp kodoliem sāk darboties elektrostatiskie atgrūšanas spēki. Šķērslis atomu tuvībai ir to iekšējo elektronu apvalku nesaderība.

Izmēri
Nav iespējams redzēt molekulas ar neapbruņotu aci. Tie ir tik mazi, ka pat mikroskops ar 1000x palielinājumu mums nepalīdzēs tos ieraudzīt. Biologi novēro baktērijas, kuru izmērs ir 0,001 mm. Bet molekulas ir simtiem un tūkstošiem reižu mazākas par tām.
Mūsdienās noteiktas vielas molekulu struktūru nosaka ar difrakcijas metodēm: neitronu difrakciju, rentgenstaru difrakcijas analīzi. Ir arī vibrāciju spektroskopija un elektronu paramagnētiskā metode. Metodes izvēle ir atkarīga no vielas veida un tās stāvokļa.
Molekulas izmērs ir relatīvs lielums, ņemot vērā elektronu apvalku. Punkts ir elektronu attālumi no atomu kodoliem. Jo lielāki tie ir, jo mazāka iespēja atrast molekulas elektronus. Praksē molekulu izmērus var noteikt, ņemot vērā līdzsvara attālumu. Tas ir attālums, par kādu pašas molekulas var pietuvoties, kad tās ir blīvi iepakotas molekulārā kristālā un šķidrumā.
Lieli attālumi mēdz piesaistīt molekulas, un mazi attālumi, gluži pretēji, mēdz atgrūst. Tāpēc molekulāro kristālu rentgenstaru difrakcijas analīze palīdz noteikt molekulas izmēru. Izmantojot gāzu difūzijas, siltumvadītspējas un viskozitātes koeficientu, kā arī vielas blīvumu kondensētā stāvoklī, iespējams noteikt molekulu izmēru lieluma kārtu.