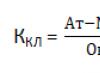Alkoholiskā aknu slimība ir orgāna struktūras izmaiņas un tā funkciju traucējumi sistemātiskas alkohola lietošanas ietekmē. Saskaņā ar statistiku, tas skar vairāk nekā 70% cilvēku, kas cieš no hroniska alkoholisma, tas ir, dzer alkoholu lielos daudzumos 5 gadus vai ilgāk.
85% gadījumu, kad etanols nonāk organismā, tas mijiedarbojas ar alkohola dehidrogenāzes (AlkDH) un acetātdehidrogenāzes enzīmiem, ko ražo kuņģis un aknas. Alkohols organismā sadalās dažādos ātrumos, ko nosaka ģenētiskās īpašības. Sadalīšanas rezultātā uzkrājas toksiski produkti, kas pēc tam tieši ietekmē aknu audu šūnas.
Epidemioloģija
Rietumos izdzertā alkohola daudzums ir diezgan liels. Tādējādi ASV viens amerikānis izdzer vidēji 10 litrus tīra etilspirta, vairāk nekā 15 miljoni cilvēku šeit ir ļoti atkarīgi no alkohola. Uz katriem 11 vīriešiem alkoholiķiem ir 4 apgādājamas sievietes.
Saslimstības līmenis ar ALD dažās valstīs var sasniegt 40% citu aknu slimību vidū. Alkoholisms tikai 15% gadījumu izraisa cirozi.
Alkohola aknu slimība ir iekļauta starptautiskajā slimību klasifikācijā 10 - ICD 10, un tai ir kods K70.
Riska faktori
Sievietēm ir lielāks risks saslimt ar šo slimību nekā vīriešiem visos vienādos apstākļos. Turklāt liela nozīme ir ģenētikai un cilvēka uzturam. Tālāk mēs runāsim par visiem šiem faktoriem sīkāk.
Stāvs
Neskatoties uz to, ka vīriešiem tiek novērota bieža alkohola lietošana, sievietēm ir lielāks ALD attīstības risks, kas saistīts ar zemu AlcDH saturu kuņģa gļotādā. Sievietēm par atkarību no alkohola bieži nav aizdomas, un viņas visbiežāk pie ārsta vēršas slimības pēdējā stadijā. Ja viņa lieto mazāku alkohola devu, joprojām tiek novērota augsta ALD attīstība. Tas notiek etanola tilpuma lēnas sadales dēļ kuņģī. Šī iemesla dēļ sievietēm pat pēc pilnīgas alkohola lietošanas var rasties ciroze.
Ģenētika
Ģenētiskā līmenī nav noslieces uz ALD, lai gan pastāv uzvedības modeļu pārnešanas modelis, kas saistīts ar alkohola lietošanu. Dažādiem cilvēkiem alkohola izvadīšanas ātrums no organisma atšķiras. Turklāt identiskiem dvīņiem ir lielāka nosliece uz alkoholismu nekā dvīņiem.
Etilspirta izdalīšanās ātrumu ietekmē enzīmu sistēmu polimorfisms. Īpaši aktīvo formu AlkDG2 un AlkDG3 poliformisms darbojas kā aizsargājoša īpašība, jo jo augstāka ir acetaldehīda uzkrāšanās pakāpe, jo zemāka kļūst tolerance pret alkoholu. Ja cilvēks ar šādām AlcDH formām pārmērīgi lieto alkoholu, viņa aknās pārmērīgi palielināsies acetaldehīda daudzums, kas nodrošinās lielu ALD attīstības iespējamību.
Aldehīda dehidrogenāzes (AldH) ietekmē acetaldehīds kļūst par acetātu. Aldehīda oksidēšanās process lielākoties notiek galvenā mitohondriju enzīma AlDHN2 dēļ. Heterozigotiem gēnam, kas kodē AldDHN2, ir traucēta acetaldehīda metabolisms, kas nosaka ievērojamu ALD attīstības iespējamību. Tas nav viens ģenētisks defekts, bet gan vairāku gēnu kombinācija, kas, visticamāk, ietekmē aknas, kas ir pietiekami neaizsargātas pret etanola kaitīgo ietekmi.
Uzturs
Slikts sociāli ekonomiskais stāvoklis nosaka zemo uztura kvalitāti cilvēkam, kas cieš no alkoholisma. Jo sliktāk ir, jo lielāka iespējamība saslimt ar ALD, jo organismā nonāk mazs proteīnu skaits un kopumā pārtikas enerģētiskā vērtība ir zema. Diezgan ērtos apstākļos slimības attīstība ir maz ticama. Slimības dekompensētajā stadijā pacienta stāvoklis pakāpeniski uzlabojas, ja viņš ievēro diētu, kas satur tādu alkohola daudzumu uzturā, kas nodrošina organismu ar 1/3 no diennakts kaloriju daudzuma. Ja organisms nesaņem nepieciešamo olbaltumvielu daudzumu, tad pilnīga atteikšanās no alkohola nemainīs aknu stāvokli. Pastiprinās alkohola toksiskā iedarbība olbaltumvielu trūkuma dēļ.
Aknu bojājuma mehānismi
Noteikta alkohola deva var nodrošināt organismu ar 50% no ikdienas kaloriju nepieciešamības. Eksperiments par alkohola tiešo hepatotoksisko iedarbību parādīja, ka 8-10 dienu laikā brīvprātīgajiem, kuri patērēja 300-600 ml alkohola, novēroja taukainas izmaiņas, kā arī tika bojāta aknu struktūra.
Alkoholiķiem acetaldehīda līmenis asinīs palielinās, bet tikai neliela daļa no tā iziet no aknām. NADH/NAD attiecība būtiski mainās hepatocītos, kas oksidē alkohola sadalīšanās produktus, kas izraisa nozīmīgus vielmaiņas traucējumus. Acetaldehīda ietekmē mitohondriji uzbriest un mainās to kristāli.
Uzkrājoties olbaltumvielām, organismā tiek aizturēts ūdens, kas izraisa hepatocītu pietūkumu, kas ir stimuls hepatomegālijai alkoholiķiem.
Regulāra etilspirta lietošana izraisa tauku uzkrāšanos aknās, izraisot to imūnsistēmas bojājumus. Ciroze var rasties paralēli fibrozei, izlaižot alkohola hepatīta stadiju.
ALD patomorfoloģija
Alkoholisko aknu slimību patoloģiskā anatomija ietver vairākas formas:
- Alkohola adaptīvā hepatopātija ir ALD sākuma stadija un tiek konstatēta 15-20% pacientu. Tas ir gandrīz asimptomātisks, ir iespējamas sāpes labajā pusē.
- Alkohola taukainu aknu slimība ir sākotnējā, visizplatītākā parādība, ko izraisa pārmērīga etanola lietošana. Slimība ir saistīta ar mikrovezikulāro tauku uzkrāšanos aknās, tās palielinās un parādās dzeltena nokrāsa.
- Alkoholiskais hepatīts (steatohepatīts) ir tauku hepatozes, plaša aknu iekaisuma un dažāda smaguma aknu nekrozes kombinācija.
- Aknu ciroze ir hroniska difūza aknu slimība, kurā audi mirst un tiek aizstāti ar šķiedru šķiedrām. Slimības gaitā veidojas dažāda izmēra mezgli, mainot orgāna struktūru. Jo ilgāks ir slimības ilgums, jo lielāka iespējamība, ka pat tad, ja jūs atturēsities no alkohola lietošanas, tā turpinās attīstīties.
- Alkoholiskā aknu mazspēja ir simptomu kopums, kas norāda uz vienas vai vairāku aknu funkciju pārkāpumu. Tas var būt akūts vai hronisks.
Simptomi
Kopumā tauku deģenerācija notiek praktiski bez simptomiem. Pacients ar steatozi var pamanīt trulas sāpes labajā pusē, viņa apetīte pasliktinās, un bieži parādās slikta dūša. Ar 15-20% varbūtību paralēli steatozei var būt dzelte.
Alkoholiskais hepatīts var progresēt bez būtiskiem simptomiem. Slimība ātri pāriet, kas var izraisīt ātru nāvi. Šajā slimības stadijā pacients:
- apetīte pasliktinās;
- svara zudums;
- parādās slikta dūša;
- ir vispārējs vājums;
- izkārnījumi ir traucēti;
- iespējama dzelte;
- biežas sūdzības par drudzi, niezi.
Hroniskā slimības formā parādās šādi simptomi:
- sāpju sindroms (trulas sāpes labajā pusē);
- grēmas;
- problēmas ar izkārnījumiem;
- apetītes zudums;
- var būt dzelte.
Slimojot ar cirozi, pacientam rodas:
- liels skaits mazu zemādas trauku uz ķermeņa un sejas;
- vēdera sienas sapēnas vēnas paplašinās;
- plaukstu āda kļūst sarkana;
- naglas un gala falangas ir deformētas;
- Vīriešiem sēklinieki var samazināties līdz ar piena dziedzeru palielināšanos.
Slimību pavada Dupuitrena kontraktūra (plaukstas cīpslu izliekums un saīsināšana), ievērojami palielinās pieauss dziedzeri.
Komplikācijas
Ja nepārtraucat pārmērīgu alkohola lietošanu, laika gaitā attīstīsies hroniska alkohola aknu slimība. Tas var izraisīt aknu vēzi, ascītu (šķidruma uzkrāšanos vēdera dobumā), peritonītu, nozīmīgus nieru darbības traucējumus un kuņģa-zarnu trakta asiņošanu. Pēc kāda laika aknas pārstāj neitralizēt zarnu radīto toksisko vielu uzkrāšanos.
Uzkrājoties smadzenēs, tie veicina aknu encefalopātijas attīstību. Raksturīgās slimības pazīmes ir:
- samazināta koncentrācija;
- slikts miegs;
- depresija;
- aizkaitināmība;
- trauksme;
- miegainība;
- dažādi uzvedības traucējumi;
- nāvi nevar izslēgt.
Diagnostika
Pirms ārstēšanas pacientam jāveic pārbaude. Ārsts apkopo anamnēzi, kurā ņem vērā lietoto alkoholisko dzērienu veidu, biežumu un skaitu, konstatē vienlaicīgas nervu sistēmas un iekšējo orgānu slimības un veic laboratorisko izmeklēšanu. Ārsts arī iztaujā pacientu par sliktu ieradumu un slimību klātbūtni, kā arī veic pārbaudi.
Ja pacientam ir aizdomas par atkarību no alkohola, iespējams izmantot CAGE anketu, kurā ir ietverti metodoloģiski jautājumi, kas palīdz identificēt pacienta problēmas, kas saistītas ar pārmērīgu alkohola lietošanu.
Lai identificētu slimību, tiek veikta šāda diagnostika:
- Vēdera dobuma un aknu ultraskaņa;
- Doplerogrāfija;
- radionukleīnskābes tests;
- aknu audu biopsija.
 MRI
MRI Alkohola izraisītas aknu slimības ārstēšana
Lai terapija būtu veiksmīga, pacientam vispirms jāpārtrauc alkohola lietošana. Tiek noteikts īpašs sabalansēts uzturs. Alkoholisko aknu slimību ārstēšanai izmanto: infūzijas terapiju ar piridoksīna, glikozes un kokarboksilāzes šķīdumiem.
Lai atjaunotu aknu audus, tiek noteikti būtiski fosfolipīdi. Lai novērstu hepatītu, ir paredzēts Ursosan. Tas darbojas kā choleretic līdzeklis, kā arī palīdz regulēt lipīdu metabolismu. Neirotoksisko iedarbību novērš zāles Heptral. Ārstēšana tiek veikta ārsta uzraudzībā. Gadījumos, kad slimība ir dzīvībai bīstamā stadijā, tiek lietoti kortikosteroīdi un iespējama aknu transplantācija.
- Pārtrauciet lietot alkoholu.
- Sabalansēts un diezgan kaloriju bagāts uzturs.
- Savlaicīga alkohola aknu slimības ārstēšana.
Ir arī tradicionālās metodes ALD ārstēšanai. Bet tos var lietot tikai pēc ārsta ieteikuma, nevis pašārstēšanos. Tradicionālās medicīnas receptes aknu veselībai ietver kukurūzas zīda, kurkuma, ķiploku, auzu, medus ar kanēli un dažu citu produktu izmantošanu.
Prognoze
ALD prognoze nosaka stadiju, kurā slimība atrodas. Taukainas deģenerācijas gadījumā vislabāk, cirozes klātbūtnē – vissliktāk. Tāpat pozitīvo prognozi ietekmē atturēšanās no alkohola lietošanas.
Galvenie ziņojumi no Eiropas Aknu izpētes asociācijas atjauninātajām klīniskajām vadlīnijām
1. Standarta alkohola deva Tika izvēlēts PVO ieteiktais, kas satur 10 gramus tīra spirta. Bieža epizodiska lietošana ir līdzvērtīga vairāk nekā 60 gramu tīra alkohola uzņemšanai vienā reizē. Pārmērīga alkohola lietošana - 4 vai vairāk standarta devu lietošana divu stundu laikā sievietēm, 5 vai vairāk vīriešiem.
2. Alkohols ir atzīts kancerogēns, tā lietošana ir saistīta ar paaugstinātu risku saslimt ar vairākiem vēža veidiem, sākot ar devām, kas pārsniedz alkohola standarta devu dienā.
3. Ir pārliecinoši pierādījumi tam alkohola lietošana lielos daudzumos palielina risku
- kardiomiopātija,
- arteriālā hipertensija,
- priekškambaru aritmijas un
- hemorāģisks insults.
4. Alkohols ir cirozes riska faktors tomēr vēl nav skaidrs, vai pastāv uzņemšanas slieksnis, pie kura rodas risks.
5. Mērens alkohola patēriņš samazina koronāro artēriju slimības risku.
- “Alkoholiķa”, “alkohola atkarības” vietā tiek piedāvāts lietot terminu “ alkohola lietošanas traucējumi"(RSUA);
- AUDIT vai AUDIT-C jāizmanto, lai pārbaudītu alkohola lietošanas traucējumus (AUD);
- Pacienti ar MSAD jāpārbauda attiecībā uz garīgiem traucējumiem un citām atkarībām;
- Benzodiazepīni jālieto, lai ārstētu alkohola abstinences sindromu, bet ne ilgāk par 10-14 dienām, jo ir iespējama ļaunprātīga izmantošana un/vai encefalopātija;
- Farmakoterapija jāapsver pacientiem ar RSAD un ar alkoholu saistītu aknu slimību;
- aknu biopsija nepieciešama diagnostikas nenoteiktības gadījumos, kad nepieciešams precizēt fibrozes stadiju;
- Pacientu ar RSAD skrīningam jāietver aknu testi un aknu fibrozes pakāpes noteikšana;
- Ir ieteicams kontrolēt alkohola lietošanas pārtraukšanu, mērot etilglikuronīdu (EtG) urīnā vai matos.
Alkoholiskais hepatīts (AH)
Nesenai dzeltenībai ar pārmērīgu alkohola lietošanu vajadzētu likt ārstiem aizdomas par alkohola hepatītu (AH).
Ja nav aktīvas infekcijas, pacientiem ar smagu hipertensiju jāapsver kortikosteroīdu (prednizolona 40 mg/dienā vai metilprednizolona 32 mg/dienā) lietošana, lai samazinātu īslaicīgu mirstību.
Tomēr kortikosteroīdi neietekmē vidēja termiņa un ilgtermiņa izdzīvošanu. N-acetilcisteīnu (intravenozi 5 dienas) var kombinēt ar kortikosteroīdiem pacientiem ar smagu hipertensiju. Kā pirmās līnijas iejaukšanās ir nepieciešama perorāla ikdienas uzņemšana ≥ 35–40 kcal/kg ķermeņa svara un 1,2–1,5 g/kg proteīna.
Pirms ārstēšanas uzsākšanas, kortikosteroīdu terapijas laikā un novērošanas periodā jāveic regulāra infekciju skrīnings.
Ir nepieciešams savlaicīgi (septītajā dienā) noteikt atbildes reakciju uz kortikosteroīdu terapiju un ievērot stingrus terapijas pārtraukšanas noteikumus.
Alkohola pārmērīgas lietošanas izraisīta aknu fibroze un ciroze
Pacientiem ar cirozi, ko izraisa pārmērīga alkohola lietošana, jāiesaka pilnībā atturēties no alkohola lietošanas, lai samazinātu komplikāciju un mirstības risku.
Versija: MedElement slimību direktorijs
Alkoholiskais hepatīts (K70.1)
Gastroenteroloģija
Galvenā informācija
Īss apraksts
Alkohola aknu slimība ir aknu slimība, ko izraisa ilgstoša toksisku etanola devu uzņemšana. Alkohola aknu slimība apvieno dažādus parenhīmas struktūras traucējumus Parenhīma ir iekšējo orgānu galveno funkcionējošo elementu kopums, ko ierobežo saistaudu stroma un kapsula.
aknas un hepatocītu funkcionālais stāvoklis hepatocīts - galvenā aknu šūna: liela šūna, kas veic dažādas vielmaiņas funkcijas, tostarp dažādu organismam nepieciešamo vielu sintēzi un uzkrāšanos, toksisko vielu neitralizāciju un žults veidošanos (hepatocītu)
ko izraisa sistemātiska alkoholisko dzērienu lietošana.
"Alkoholiskais hepatīts"- termins, kas pieņemts SSK-10, lai apzīmētu akūtus deģeneratīvus un iekaisīgus aknu bojājumus, ko izraisa alkohola iedarbība un kas var pārveidoties par aknu cirozi. Aknu ciroze ir hroniska progresējoša slimība, kurai raksturīga aknu parenhīmas deģenerācija un nekroze, ko pavada tās mezglu reģenerācija, saistaudu difūza proliferācija un dziļa aknu arhitektonikas pārstrukturēšana.
.
Alkoholiskais hepatīts ir viens no galvenajiem alkohola aknu slimības variantiem. Tāpat kā alkoholisko fibrozi, arī alkoholisko hepatītu uzskata par cirozes priekšvēstnesi jeb sākotnējo un obligāto stadiju.
Alkoholisko hepatītu var kombinēt arī ar taukainu aknu slimību, alkoholisko fibrozi un cirozi.
Piezīme. Akūtas alkohola etioloģijas toksiskās aknu nekrozes epizodes kopā ar akūtu alkoholisko hepatītu tiek apzīmētas kā “alkoholiskā steatonekroze”, “aknu sklerozējošā hialīna nekroze”, “toksiskais hepatīts”, “akūta aknu mazspēja hroniskiem alkoholiķiem”.
Klasifikācija
Lielākā daļa ārstu izšķir akūtu un hronisku alkoholisko hepatītu.
Alkoholiskā hepatīta vispārējā klasifikācija(Loginova A.S. et al.):
1. Hronisks alkoholiskais hepatīts:
- ar mērenu aktivitāti;
- ar izteiktu aktivitāti;
- kombinācijā ar alkoholisko hepatītu.
2. Akūts alkoholiskais hepatīts (akūta alkohola aknu nekroze):
- kombinācijā ar hronisku alkohola hepatopātiju;
- attīstīta neskartās aknās;
- ar intrahepatisku holestāzi;
- viegla (anikteriskā) forma;
- mērena forma;
- smaga forma.
Smaguma pakāpi var noteikt arī, izmantojot skalas (skat. sadaļu "Prognozes"). Saskaņā ar iegūto punktu skaitu alkoholisko hepatītu var iedalīt smagajā un nesmagajā.
Etioloģija un patoģenēze
Etioloģija
Alkohols ir tiešs hepatotoksisks līdzeklis. Tā metabolismā ir iesaistītas vairākas enzīmu sistēmas, kas etanolu pārvērš acetaldehīdā un pēc tam acetaldehīda dehidrogenāzē. Acetaldehīda dehidrogenāze ir cilvēka aknās atrodams enzīms, kas ir atbildīgs par acetaldehīda sadalīšanos (pārvērš acetaldehīdu etiķskābē).
(ALDH) tiek metabolizēts tā acetātā.
Galvenais faktors alkohola aknu slimības attīstībā ir augstais acetaldehīda saturs tajā. Tas izraisa lielāko daļu etanola toksiskās iedarbības, tostarp palielinot lipīdu peroksidāciju, noturīgu kompleksu veidošanos ar olbaltumvielām, traucējot mitohondriju darbību un stimulējot fibroģenēzi.
Alkohola aknu slimības attīstības risks rodas, izdzerot vairāk nekā 40-80 g tīra etanola dienā. Dzerot vairāk nekā 80 g tīra etanola 10 gadus vai ilgāk, palielinās aknu cirozes risks. Nav tiešas korelācijas starp aknu bojājuma pakāpi un izdzertā alkohola daudzumu: saskaņā ar dažiem datiem mazāk nekā 50% cilvēku, kuri lieto alkoholu bīstamās devās, ir smagas aknu bojājuma formas (hepatīts un ciroze).
Patomorfoloģija
1. Akūts alkoholiskais hepatīts. Histoloģiskās izpausmes:
1.1 Strukturālās izmaiņas aknās, kas nepieciešamas alkoholiskā hepatīta gadījumā:
- perivenulāri hepatocītu bojājumi;
- balonu distrofija un nekroze;
- Mallory ķermeņu klātbūtne (alkoholiskais hialīns);
- leikocītu infiltrācija;
- pericelulārā fibroze.
1.2 Simptomi, kas nav nepieciešami alkohola hepatīta diagnosticēšanai:
- taukainas aknas;
- milzu mitohondriju, acidofilo ķermeņu, oksifilo hepatocītu identificēšana;
- aknu vēnu fibroze;
- žults ceļu izplatīšanās;
- holestāze.
Perivenulāri hepatocītu bojājumi
Akūtu alkoholisko hepatītu raksturo hepatocītu perivenulāri bojājumi vai Rappoport aknu acini trešā zona (mikrocirkulācijas perifērija). Alkohola vielmaiņas laikā tiek novērota izteiktāka skābekļa spriedzes samazināšanās, salīdzinot ar normu, virzienā no aknu artērijas un vārtu vēnas uz aknu vēnu. Perivenulāra hipoksija veicina hepatocelulārās nekrozes attīstību, kas galvenokārt atrodama aknu sešstūra daivu centrā.
Balonu distrofija un Mallory ķermeņi
Ar hepatocītu balonu deģenerāciju tiek novērots atsevišķu hepatocītu pietūkums, palielinoties to izmēram, citoplazmas attīrīšanai un kariopiknozi. Kariopiknoze ir šūnas kodola saraušanās process distrofisku izmaiņu laikā tajā.
.
Mallory ķermeņi (alkoholiskais hialīns) tiek atklāti centrilobulāri, izmantojot Mallory trīskrāsu traipu; veidojas gan aknu šūnu citoplazmā, gan ekstracelulāri. Alkohola hialīna noteikšana raksturo aknu bojājuma smagumu.
Alkoholiskajam hialīnam var būt fibrilāra, smalki un rupji granulēta struktūra. Fibrilārais alkoholiskais hialīns tiek konstatēts akūta alkohola hepatīta augstumā. Vēlāk, kad slimība norimst, tā pārvēršas granulētā materiālā.
Iekaisīga polinukleāro leikocītu infiltrācija ar nelielu limfocītu piejaukumu tiek noteikta daivas iekšpusē un portāla traktos. Lobulas iekšpusē leikocīti tiek konstatēti hepatocītu nekrozes perēkļos un ap šūnām, kas satur spirtu saturošu hialīnu, kas ir saistīts ar alkohola hialīna leikotoksisko iedarbību. Kad slimība norimst, alkoholiskais hialīns ir retāk sastopams.
Pericelulārā fibroze ir svarīga alkoholiskā hepatīta pazīme, un tās izplatība ir galvenais rādītājs slimības prognozēšanai. Alkoholam un tā metabolītiem (īpaši acetaldehīdam) var būt tieša fibrogēna iedarbība. Šķiedru audi tiek nogulsnēti gar sinusoīdiem un ap hepatocītiem alkoholiskā hepatīta sākuma stadijā. Ito šūnas, fibroblasti, miofibroblasti un hepatocīti sintezē dažāda veida kolagēnu un nekolagēnu proteīnus.
2. Hronisks alkoholiskais hepatīts:
2.1. Hronisks persistošs hepatīts: alkoholiskā hepatīta raksturīgās izpausmes kombinējas ar mērenu pericelulāru un subsinusoidālu fibrozi acinārās aknu daivas trešajā zonā. Dažos gadījumos portāla trakti ir palielināti un tiek novērota portāla fibroze. Šis attēls var saglabāties 5-10 gadus bez progresējošas fibrozes un pārejas uz cirozi, pat turpinot alkohola lietošanu.
2.2. Hronisks aktīvs hepatīts: alkohola hepatīta histoloģiskais attēls kombinācijā ar aktīvu fibroģenēzi. Kopā ar ievērojamu fibrozi daivas trešajā zonā tiek atzīmēta sklerozējošā hialīna nekroze. Pēc 3-5 mēnešu abstinences morfoloģiskās izmaiņas atgādina hroniska agresīva bezalkoholiskā hepatīta attēlu.
Hroniska alkohola hepatīta gadījumā procesa progresēšana dažos gadījumos tiek novērota pat pēc alkoholisko dzērienu lietošanas pārtraukšanas autoimūnas destruktīvas reakcijas pievienošanas rezultātā.
Epidemioloģija
Izplatības pazīme: bieži
Vecums. Akūts alkoholiskais hepatīts visbiežāk attīstās 25-35 gadu vecumā pēc smagas dzeršanas un 10 un vairāk gadus ilgas alkohola lietošanas. Visu alkoholiskā hepatīta formu vecuma diapazons var svārstīties no 25 līdz 70 gadiem. Amerikas Savienotajās Valstīs alkohola hepatīta slimnieku vidējais vecums ir aptuveni 50 gadi, un alkohola lietošana sākas 17 gadu vecumā.
Izplatība. Pēc minimālākajām aplēsēm Rietumvalstu populācijā pacientu skaits ir aptuveni 1-2%. Sakarā ar vieglu alkohola hepatīta formu asimptomātisku gaitu, pacientu populācijā, kas mēreni lieto alkoholu un pārmērīgi lieto alkoholu, slimības izplatība (pēc biopsijas datiem) ir 25-30%.
Dzimuma attiecība dažādās valstīs atšķiras. Tiek uzskatīts, ka alkohola hepatīta attīstības ātrums sievietēm ir 1,7 reizes lielāks nekā vīriešiem. Tomēr, ņemot vērā vīriešu pārsvaru dzērāju grupā, dzimumu attiecības nozīme pacientu grupā joprojām nav zināma.
Race. Kaukāza rasei ir zemāks alkohola hepatīta attīstības līmenis nekā negroidu un mongoloīdu rasēm.
Riska faktori un grupas
Riska faktori slimības attīstībai un progresēšanai:
- 40-80 gramu etanola uzņemšana dienā 10-12 gadus;
- ģenētiski noteikti enzīmu fenotipi, kas nodrošina augstu etanola metabolisma ātrumu un acetaldehīda uzkrāšanos;
- infekcija ar hepatotropiskiem vīrusiem;
- liekais ķermeņa svars;
- nepietiekams uzturs;
- sieviete.
Klīniskā aina
Klīniskās diagnostikas kritēriji
Anoreksija, slikta dūša, vemšana, svara zudums, sāpes vēdera augšējā labajā kvadrantā, drudzis, dzelte, hepatomegālija, splenomegālija, dispepsija, vājums, slikta dūša, vemšana
Simptomi, kurss
Anamnēze
Alkoholiskā hepatīta diagnostika ir saistīta ar zināmām grūtībām, jo ne vienmēr ir iespējams iegūt pietiekami pilnīgu informāciju par pacientu.
Alkohola atkarības kritēriji(diagnosticēts, pamatojoties uz trim no iepriekšminētajām pazīmēm):
Pacients lieto alkoholiskos dzērienus lielos daudzumos un viņam ir pastāvīga vēlme tos lietot;
Lielāko daļu sava laika pavadot alkohola iegādei un tā lietošanai;
Alkohola lietošana dzīvībai bīstamās situācijās vai gadījumos, kad tiek pārkāptas pacienta saistības pret sabiedrību;
Alkohola lietošana kopā ar pacienta sociālās un profesionālās darbības samazināšanos vai pārtraukšanu;
alkohola lietošanas turpināšana, neskatoties uz pacienta psiholoģisko un fizisko problēmu saasināšanos;
Palielināt patērētā alkohola daudzumu, lai sasniegtu vēlamo efektu;
- atcelšanas simptomu parādīšanās;
Nepieciešamība lietot alkoholu, lai mazinātu abstinences simptomus.
Alkohola pārmērīga lietošana(noteikts pēc vienas vai divu pazīmju klātbūtnes):
Alkohola lietošana, neraugoties uz pieaugošajām pacienta sociālajām, psiholoģiskajām un profesionālajām problēmām;
Atkārtota alkohola lietošana dzīvībai bīstamās situācijās.
Apšaubāmos gadījumos, diagnosticējot kādu aknu slimību vai ja ir aizdomas par pārmērīgu alkohola lietošanu, ieteicams izmantot īpašu anketu.
Alkoholiskā hepatīta klīniskās gaitas veidi:
1. Akūts alkoholiskais hepatīts:
1.1 Asimptomātiska vai viegla gaita ar pakāpenisku sākumu (apmēram 50% pacientu). Vienīgā sūdzība bieži vien ir dispepsija.
1.2. Akūtas toksiskas aknu nekrozes klīniskā aina ir klasiski raksturīga:
- drudzis (40%);
- dispepsija Dispepsija ir gremošanas traucējumi, kas parasti izpaužas kā sāpes vai diskomforts krūškurvja lejasdaļā vai vēdera lejasdaļā, kas var rasties pēc ēšanas, un dažreiz to pavada slikta dūša vai vemšana.
;
- sāpes labajā hipohondrijā (50%);
- caureja, slikta dūša, vemšana;
- anoreksija;
- vājums;
- svara zudums.
1.3 Dzeltes variants - nosaka dzeltes klātbūtnē. Biežākais akūta alkohola hepatīta variants (35% gadījumu). Dzelte parasti nav saistīta ar niezi un bieži vien ir mērena.
1.4 Holestātiskais variants (5-13% gadījumu): intrahepatiskās holestāzes simptomi Holestāze ir žults kustības pārkāpums stagnācijas veidā žultsvados un (vai) kanālos.
(ādas nieze, dzelte, gaiši izkārnījumi, tumšs urīns, drudzis).
1.5. Fulminants akūts alkoholiskais hepatīts: var līdzināties visiem akūta alkohola hepatīta klīniskajiem variantiem (izņemot latento), bet to raksturo strauja progresēšana, attīstoties aknu un nieru mazspējai un ātrai nāvei.
2. Hronisks alkoholiskais hepatīts: izpausmes, kas līdzīgas citām etioloģiskajām hepatīta formām. Bieži tiek novēroti dispepsijas traucējumi.
Objektīva pārbaude
Raksturīga ir hepatomegālija Hepatomegālija ir ievērojama aknu palielināšanās.
. Gandrīz visiem pacientiem aknas ir palielinātas, bieži vien ir saspiestas, tām ir gluda virsma, tās ir sāpīgas. Sāpes ir izkliedētas.
Iespējama splenomegālija Splenomegālija - pastāvīga liesas palielināšanās
, ādas telangiektāzija Telangiektāzija ir lokāla pārmērīga kapilāru un mazu asinsvadu paplašināšanās.
, plaukstu eritēma Eritēma - ierobežota ādas hiperēmija (palielināta asins piegāde).
.
Var rasties alkohola un aknu encefalopātija Encefalopātija ir vispārējs nosaukums smadzeņu slimībām, kurām raksturīgas deģeneratīvas izmaiņas.
, kā arī asterixis Asterikss ("pop" simptoms, plaukstas krišana) - nespēja saglabāt fiksētu stāju, plandošs trīce - lēna un neregulāra ekstremitāšu locīšana un pagarināšana
, kā pēdējā izpausme.
Bieži attīstās ascīts Ascīts - transudāta uzkrāšanās vēdera dobumā
, kas ar smagu fibrozi un centrālo vēnu obstrukciju var būt rezistenti pret diurētisku terapiju.
Ar alkohola hepatītu bieži tiek novērotas vienlaicīgas bakteriālas infekcijas: pneimonija, sinusīts, pielonefrīts Pielonefrīts - galvenokārt nieru un nieru iegurņa intersticiālu audu iekaisums
, aktīva plaušu tuberkuloze, gramnegatīva septicēmija Septicēmija ir sepses forma, kurā patogēno mikroorganismu klātbūtne asinīs nav saistīta ar metastātisku strutojošu iekaisumu perēkļu veidošanos.
. Ir iespējami atsevišķi peritonīta gadījumi Peritonīts ir vēderplēves iekaisums.
un abscess Abscess - dobums, kas piepildīts ar strutas un norobežots no apkārtējiem audiem un orgāniem ar piogēnu membrānu
plaušas.
Diagnostika
Alkoholiskā hepatīta diagnosticēšanas kritērijs ir alkohola anamnēzes un specifisku histoloģisko pazīmju klātbūtne (skatīt sadaļu “Etioloģija un patoģenēze”). Liela nozīme ir klīniskajiem un laboratoriskajiem parametriem. Aknu attēlveidošanai ir mazāka nozīme diagnostikā.
Instrumentālās studijas
1. Ultraskaņa:
- aknu parenhīmā ir difūza, hiperehoiska struktūra;
- cirozes stadijā - atbilstošs sonogrāfiskais attēls.
2.Krāsu duplekssonogrāfija Krāsu duplekssonogrāfija ir neinvazīva un neradioaktīva diagnostikas metode artēriju un vēnu analīzei (Doplera tehnoloģijas un ultraskaņas attēlveidošanas kombinācija)
:
nosakot aknu asinsrites virzienu, nodrošinājuma cirkulācijas attīstības pakāpi un asins recekļu klātbūtni aknu traukos.
3.FEGDS FEGDS - (viena no gremošanas trakta augšējās daļas izmeklēšanas metodēm, kas ļauj pārbaudīt barības vada, kuņģa un divpadsmitpirkstu zarnas iekšējo virsmu)
veic, lai noteiktu barības vada un kuņģa varikozu vēnu esamību un pakāpi, atklātu portāla gastropātiju (erozīvi-hemorāģisko gastrītu) un novērtētu asiņošanas risku.
Rektoskopiju izmanto, lai identificētu anorektālos varikozos mezglus.
4. Laparoskopija Laparoskopija (peritoneoskopija) ir vēdera dobuma orgānu izpēte, tos izmeklējot, izmantojot medicīniskos endoskopus, kas ievietoti vēderplēves dobumā caur vēdera sienas punkciju.
ar aknu biopsiju ļauj aprakstīt aknu virsmu, reģenerācijas mezglu izmērus un morfoloģiski apstiprināt diagnozi. Šie pētījumi tiek veikti tikai tad, ja tiem nav kontrindikāciju. Piemēram, aknu perkutānā adatas biopsija bieži vien nav iespējama kontrindikāciju (galvenokārt koagulopātijas) dēļ un ir saistīta ar lielu skaitu diagnostikas kļūdu.
5. Kad aknu adatas biopsija ar histoloģisku izmeklēšanu viņi atklāj:
- hepatocīti balona un tauku deģenerācijas stāvoklī;
-
masīva lobulāra infiltrācija ar polimorfonukleāro leikocītu pārsvaru un fokālās nekrozes zonām;
-
Malorijas ķermeņi (dažreiz), kas, krāsoti ar hematoksilīna-eozīnu, ir purpursarkani citoplazmas ieslēgumi, kas sastāv no kondensētiem citoskeleta starpposma mikrofilamentiem;
Dažādā pakāpē izteikta fibroze ar perisinusoidālu kolagēna šķiedru izvietojumu;
- dažādas pakāpes intrahepatiska holestāze.
Akūta alkoholiskā hepatīta progresējošā stadijā, kā likums, ir kontrindikācijas aknu adatas biopsijai (šajos gadījumos var veikt transjugulāro biopsiju).
6. Magnētiskās rezonanses attēlveidošanas ir augsta jutība un specifiskums aknu steatozes diagnostikā Aknu steatoze ir visizplatītākā hepatoze, kurā tauki uzkrājas aknu šūnās
un ciroze, bet ne hepatīts. Nav kritēriju, lai pierādītu konstatēto izmaiņu alkoholisko raksturu.
Laboratorijas diagnostika
Alkoholiskā hepatīta diagnoze, tāpat kā jebkura cita veida alkohola izraisīta aknu slimība, tiek noteikta, pamatojoties uz pierādījumiem par pārmērīgu alkohola lietošanu un pierādījumiem par aknu slimībām. Neviena laboratorijas marķiera izmaiņa nav galīgi saistīta ar alkoholisko hepatītu. Laboratorijas pārbaudēs konstatētās aknu slimības etioloģija var atšķirties. Turklāt alkohols var būt viens no vairākiem faktoriem, kas izraisa aknu bojājumus. Pacientiem ar potenciāli multifaktoriālu aknu slimību var būt grūti novērtēt alkohola īpašo lomu aknu bojājumu attīstībā.
Alkohola pārmērīgas lietošanas pazīmes:
- straujš gamma-glutamiltransferāzes līmeņa paaugstināšanās asins serumā un strauja tā samazināšanās abstinences laikā;
ogļhidrātu nesaturošā transferīna koncentrācijas palielināšana;
- makrocitoze (vidējais eritrocītu tilpums > 100 μm 3), kas saistīta ar paaugstinātu alkohola saturu asinīs un toksisku ietekmi uz kaulu smadzenēm; šīs zīmes specifika ir 85-91%, jutība - 27-52%.
Aknu bojājuma pazīmes:
1. Aminotransferāžu līmeņa paaugstināšanās ar AST pārsvaru vairāk nekā 2 reizes (70% gadījumu). AST palielināšanās 2-6 reizes. ASAT līmenis, kas lielāks par 500 SV/l vai ALAT lielāks par 200 SV/L, ir retāk sastopams un liecina par masīvu nekrozi (fulminantu alkohola hepatīta formu) vai citu vai kombinētu aknu bojājumu etioloģiju (piemēram, vīrusu hepatītu, acetaminofēna lietošanu utt.).
2. Iespējama sārmainās fosfatāzes līmeņa paaugstināšanās un hiperbilirubinēmija.
Akūtā alkoholiskā hepatīta gadījumā tiek novēroti šādi simptomi:
- neitrofīlā leikocitoze līdz 15-20 x 10 9 / l, dažreiz līdz 40 x 10 9 / l;
- ESR palielināšanās līdz 40-50 mm/h;
- hiperbilirubinēmija tiešās frakcijas dēļ;
- paaugstināts aminotransferāžu līmenis (AST/ALT attiecība - vairāk nekā 2);
Vairākkārtējs gamma-glutamiltransferāzes līmeņa pārsniegums (70% pacientu ar alkohola aknu slimību GGTP aktivitāte ir normas robežās);
- holestātiskā formā - paaugstināts sārmainās fosfatāzes līmenis;
Paaugstināts Ig A.
Diferenciāldiagnoze
Tiek veikta alkoholiskā hepatīta diferenciāldiagnoze ar šādām slimībām:
- bezalkoholiska taukainu aknu slimība;
- vīrusu un infekcijas hepatīts;
- žults ceļu aizsprostojums;
- neoplastiski veidojumi;
- holecistopankreatīts;
- hronisks pankreatīts.
Par noteicošo tiek uzskatīta pareizi savākta alkohola anamnēze, negatīvi infekcijas izraisītāju testi un vizualizēta žultsvadu caurlaidība. Tomēr, ja ir aizdomas par kombinētu aknu bojājumu, ir ļoti grūti noteikt dominējošo etioloģisko cēloni. Visuzticamākais diagnostikas tests šajā gadījumā ir CDT (ogļhidrātu deficīta transferīna) laboratoriskā noteikšana.
Komplikācijas
Alkoholiskā hepatīta sekas var būt:
- fibroze Fibroze ir šķiedru saistaudu proliferācija, kas rodas, piemēram, iekaisuma rezultātā.
un skleroze Skleroze ir orgāna sacietēšana, ko izraisa tā mirušo funkcionālo elementu aizstāšana ar saistaudiem (parasti šķiedrainiem) vai viendabīgu hialīnam līdzīgu masu.
aknas;
- aknu ciroze;
- aknu encefalopātija;
- aknu vēzis.
Infekcijas komplikācijas:
- pneimonija;
- sinusīts Sinusīts - viena vai vairāku deguna blakusdobumu gļotādas iekaisums
;
- sepse;
- aknu abscess (reti);
-LEDUS DIC sindroms (izkliedēta intravaskulāra koagulācija, patēriņa koagulopātija, trombohemorāģiskais sindroms) ir asins recēšanas traucējumi, ko izraisa masīva tromboplastisko vielu izdalīšanās no audiem.
;
- nieru mazspēja;
- peritonīts (reti).
Ārstēšana ārzemēs
Ārstējieties Korejā, Izraēlā, Vācijā, ASV
Saņemiet padomu par medicīnas tūrismu
Ārstēšana
Vispārīgi noteikumi
1. Alkoholiskā hepatīta ārstēšanā svarīgākais princips ir atturēšanās no alkohola. Slimība var diezgan ātri un pilnīgi regresēt (salīdzinot ar citu etioloģiju hepatītu), pilnībā pārtraucot alkohola lietošanu.
2. Pastāv būtiskas neatbilstības medikamentozajā terapijā starp Rietumu un NVS ieteikumiem.
3. Daudzām zālēm nav pierādījumu bāzes (vai arī tās ir vājas), un tās lieto vai nu tradicionāli, vai balstoties uz nelielu skaitu pētījumu.
4. Ārstēšanas pieejas laika gaitā mainās. Tālāk sniegtā informācija atspoguļo vispārpieņemtos uzskatus raksta tapšanas laikā.
5. Alkoholiskā hepatīta ārstēšana ir atkarīga no daudziem faktoriem:
Veidlapa (skat. sadaļu "Klasifikācija");
- procesa smagums;
- pacienta vecums;
- vienlaicīgu slimību un komplikāciju klātbūtne.
Diēta
Ir svarīgi ievērot diētu, kas satur pietiekamu daudzumu olbaltumvielu un kaloriju, jo cilvēkiem, kuri pārmērīgi lieto alkoholu, bieži rodas olbaltumvielu, vitamīnu un mikroelementu (īpaši kālija, magnija un fosfora) deficīts.
Folijskābes, B6 vitamīna, A vitamīna un tiamīna trūkums ir vieni no visizplatītākajiem.
Mikroelementu (piemēram, selēna, cinka, vara un magnija) līmenis bieži tiek mainīts, un dažos gadījumos tiek uzskatīts, ka tie ir iesaistīti visu veidu ar alkoholu saistītu slimību patoģenēzē.
Grūtības rodas, izvēloties diētu vienlaikus ar cukura diabētu vai aptaukošanos, jo šo pacientu uztura traucējumu spektrs ir ļoti atšķirīgs no nepietiekama uztura līdz aptaukošanās. Amerikas Gastroenteroloģijas koledža (ACG) un Amerikas Aknu slimību izpētes asociācija (AASLD) iesaka vidēji 1,2-1,5 g/kg proteīna un 35-40 kcal/kg ķermeņa svara dienā (vismaz 2000 kcal/dienā). pieaugušajam).
Ir pierādījumi par sazaroto ķēžu aminoskābju (BCAA) labvēlīgo ietekmi (ja tās tiek ievadītas uzturā).
Pierādījumi par polinepiesātināto taukskābju iekļaušanas uzturā efektivitāti joprojām ir apšaubāmi.
Kā alternatīvu barības vielu ievadīšanas ceļu (pret sliktu dūšu, vemšanu, psiholoģiskā stāvokļa izmaiņām) var izmantot endoskopiski ievietotu enterālo zondi ar programmējamu sūkni. Parenterālo barošanu (daļēju vai papildu) lieto ārkārtīgi reti.
Fiziskā aktivitāte nav ieteicams akūtā fāzē. Nākotnē tam jābūt vērstam uz svara zudumu (ja vienlaikus ir aptaukošanās). Personām ar hronisku alkoholisko hepatītu, kas notiek bez būtiskiem simptomiem, fiziskās aktivitātes ierobežošana parasti nav nepieciešama.
Infūzijas terapija
To lieto smagu akūta alkohola hepatīta formu (tostarp ar smagu holestāzi un īpaši aknu mazspēju) stacionārai ārstēšanai. Infūzijas terapija ir vērsta uz detoksikāciju, skābju-bāzes līdzsvara korekciju, hipoalbuminēmijas korekciju, koagulācijas sistēmas korekciju. Saliktos sāls šķīdumus, albumīnu, dabisko plazmu vai asinsreces faktorus parasti izmanto mērenās devās. Viņi cenšas izvairīties no koloīdu ievadīšanas.
Zāles
ASV un Apvienotās Karalistes ieteikumi
1. Sistēmiskie kortikosteroīdi (prednizolons, metilprednizolons) - nozīmēti tikai smagas formas vienlaicīgas aknu mazspējas gadījumā kursam līdz 4 nedēļām, 40 mg/dienā. (32 mg/dienā metipredam), dažkārt pakāpeniski samazinot devu 2 reizes nākamo 2-3 nedēļu laikā līdz pilnīgai atcelšanai. Izraisīt blakusparādības.
2. Pentoksifilīns - 400 mg iekšķīgi 3 reizes dienā, ja ir kontrindikācijas sistēmiskiem kortikosteroīdiem.
3. Antioksidantu terapija (C un E vitamīns un citi antioksidanti) – šobrīd nav pārliecinošu pierādījumu par efektivitāti alkoholiskā hepatīta ārstēšanā. Protams, asins seruma testēšanas laikā konstatētais vitamīnu trūkums tiek pakļauts zāļu korekcijai, ja to nav iespējams novērst ar sabalansētu uzturu.
4. Antibakteriālo terapiju veic tikai tad, ja attīstās infekcijas komplikācijas.
5. Tādas zāles kā talidamīds, misoprostols, adiponektīns un probiotiku grupa ir uzrādījušas labus rezultātus provizoriskajos pētījumos, taču tās vēl nav standarta terapija.
1. Sistēmiskie kortikosteroīdi (prednizolons) - 40 mg/dienā, 4 nedēļas.
2. Ademetionīns (heptral).
3. Silimarīns.
4. Esenciālie fosfolipīdi (ja nav holestāzes), piemēram, essentiale.
5 Ursodeoksiholskābe.
6. Antibakteriālā terapija profilaktiskos nolūkos, īss kurss (fluorhinoli).
7. Kolhicīns.
Kopsavilkums. Ir vispārpieņemti pasākumi, kuru mērķis ir atteikšanās no alkohola, uztura normalizēšana, detoksikācijas koriģējošā infūzijas terapija, kā arī sistēmisko kortikosteroīdu izrakstīšana (smagos gadījumos). Ja nav skaidras pierādījumu bāzes, citas zāles vajadzētu nozīmēt ārsts, pamatojoties uz pacienta iespējām un viņa personīgo pieredzi un spriedumiem.
Ķirurģija. Aknu transplantācija.
Prognoze
Viegls alkoholiskais hepatīts ir labdabīga slimība ar nenozīmīgu īslaicīgu mirstību. Tomēr, ja alkoholiskais hepatīts ir pietiekami smags (aknu encefalopātijas attīstība, dzelte, koagulopātija), mirstība var būt ievērojama.
Kopējais 30 dienu mirstības rādītājs pacientiem, kas hospitalizēti ar alkoholisko hepatītu, ir aptuveni 15%, bet pacientiem ar smagām formām tā tuvojas vai pārsniedz 50%.
Pacientiem bez encefalopātijas, dzeltes vai koagulopātijas Koagulopātija - asins koagulācijas sistēmas disfunkcija
30 dienu mirstības rādītājs ir mazāks par 5%.
Kopumā viena gada mirstības rādītājs pēc hospitalizācijas alkohola hepatīta dēļ ir aptuveni 40%.
Izmanto, lai prognozētu mirstību Maddray koeficients(MDF): 4,6 x (starpība starp protrombīna laiku pacientam un kontrolei) + seruma bilirubīns mmol/l.
Ja koeficients ir lielāks par 32, nāves varbūtība pašreizējās hospitalizācijas laikā pārsniedz 50%.
Daži pētījumi liecina, ka MDF var nebūt precīzs mirstības prognozētājs pacientiem ar alkohola hepatītu, īpaši tiem, kuri saņem glikokortikoīdus.
Citi faktori, kas korelē ar sliktu prognozi, ir vecāks vecums, pavājināta nieru darbība, encefalopātija un balto asinsķermenīšu skaita palielināšanās pirmajās 2 hospitalizācijas nedēļās.
Alternatīvās prognozes skalas(nav plaši izmantots):
- Toronto Universitātes apvienotais klīniskais un laboratorijas indekss;
- Aknu slimības beigu stadijas (MELD) modelis;
- Glāzgovas alkoholiskā hepatīta rādītājs (GAHS);
- Asimetriskais dimetilarginīns (ADMA).
Pēdējās divas skalas dažos pētījumos ir uzrādījušas visaugstāko prognozēšanas precizitāti.
Hospitalizācija
Hospitalizācija alkohola aknu slimības dēļ var būt gan ārkārtas, gan plānota. Pacientus bez smaga iekaisuma, aknu mazspējas vai komplikāciju pazīmēm var ārstēt ambulatori.
Profilakse
Primārā profilakse. Izvairīšanās no pārmērīgas alkohola lietošanas.
Komplikāciju novēršana
Pacienti, kas nesen izrakstīti no slimnīcas pēc akūtas alkohola hepatīta lēkmes, parasti ir intensīvi jānovēro 2 nedēļas. Turpmākas periodiskas vizītes pie ārsta ir nepieciešamas ar intervālu no nedēļām līdz vairākiem mēnešiem.
Pacientu novērošanas mērķis ir noteikt, vai viņi reaģē uz terapiju (tostarp elektrolītu līmeņa un aknu testu rezultātu uzraudzību), kā arī uzraudzīt alkohola atmešanu un veicināt atturību.
Jāatceras, ka pilnīga atturēšanās no alkohola tiek novērota ne vairāk kā 1/3 pacientu, 1/3 pacientu ievērojami samazina alkohola patēriņu un atlikušā trešdaļa ignorē ārsta ieteikumus. Pēdējiem pacientiem nepieciešams hepatologa un narkologa kopīgs darbs.
Pacientiem ar alkohola hepatītu, kuriem ir cirozes pazīmes (īpaši tiem, kuriem vienlaikus ir hronisks vīrusu hepatīts B vai C), nepieciešama periodiska uzraudzība, lai pārbaudītu hepatocelulāro karcinomu. Vispārējais skrīninga algoritms ietver seruma alfa-fetoproteīna (AFP) testēšanu ik pēc 6 mēnešiem un ultraskaņu ik pēc 12 mēnešiem.
Pacientu ar alkohola izraisītu aknu slimību imunizācija pret izplatītiem infekcijas patogēniem, tostarp A hepatīta vīrusu, B hepatīta vīrusu, pneimokokiem un A gripas vīrusu, šķiet ļoti saprātīga pieeja.
Informācija
Avoti un literatūra
- Merk rokasgrāmata. Ceļvedis medicīnā. Diagnostika un ārstēšana /red. Alus Mark H./trans. no angļu valodas rediģēja Chuchalina A.G., M.: Litterra, 2011
- Damianovs I. Patoloģijas noslēpumi / tulkojums no angļu valodas. rediģēja Kogans E. A., M.: 2006
- "Pentoksifilīns alkohola hepatīta ārstēšanai" Keita Vitfīlda, Andrea Rambaldi, Jørn Wetterslev, Christian Gluud, Cochrane Hepato-Biliary Group, The Cochrane Library, publicēts tiešsaistē: 2009. gada oktobris
- "Pacientu ar nesen diagnosticētu alkohola izraisītu aknu slimību epidemioloģija un klīniskās īpašības: populācijas uzraudzības rezultāti" Sofair AN, Barry V, Manos MM, Thomas A. utt., "Journal of Clinical Gastroenterology", Nr. 44( 4), 2010. gads
- "Alkoholiskās aknu slimības ārstēšana" Thomas H. Frazier, Abigail M. Stocker, Nicole A. Kershner, Luis S. Marsano, "Therapeutic Advances in Gastroenterology", Nr. 4(1), 2011
- "Seruma ogļhidrātu deficīta transferīna vērtību izmantošana, lai izslēgtu alkoholisko hepatītu no bezalkoholiskā steatohepatīta: izmēģinājuma pētījums" Ohtsuka T., Tsutsumi M., Fukumura A., "Alkoholisms: klīniskie un eksperimentālie pētījumi", Nr. 29, 2005. gads
- "Alkoholiskā aknu slimība" Bueverovs A.O., Mayevskaya M.V., Ivashkin V.T.
- http://www.rmj.ru/ - Krievijas medicīnas žurnāls. Neatkarīgais izdevums ārstniecības personām - 2002.gada 9.nr
- "Alkoholiskais hepatīts: ārstēšanas pamatprincipi" Adzhigaitkanova S.K.
- http://www.eurolab.ua/encyclopedia/565/46022/
- "Akūta alkohola hepatīta ārstēšanas vispārīgie principi" Bueverovs A.O.
- http://www.rmj.ru/ - Krievijas medicīnas žurnāls. Neatkarīgais izdevums ārstniecības personām - 2004. gada Nr.1
Uzmanību!
- Ar pašārstēšanos jūs varat nodarīt neatgriezenisku kaitējumu jūsu veselībai.
- MedElement mājaslapā un mobilajās aplikācijās "MedElement", "Lekar Pro", "Dariger Pro", "Slimības: terapeita rokasgrāmata" ievietotā informācija nevar un nedrīkst aizstāt klātienes konsultāciju ar ārstu. Noteikti sazinieties ar medicīnas iestādi, ja jums ir kādas slimības vai simptomi, kas jūs uztrauc.
- Medikamentu izvēle un to devas ir jāapspriež ar speciālistu. Pareizās zāles un to devu var izrakstīt tikai ārsts, ņemot vērā pacienta slimību un ķermeņa stāvokli.
- MedElement vietne un mobilās aplikācijas "MedElement", "Lekar Pro", "Dariger Pro", "Slimības: terapeita katalogs" ir tikai informācijas un uzziņu resursi. Šajā vietnē ievietoto informāciju nedrīkst izmantot, lai nesankcionēti mainītu ārsta rīkojumus.
- MedElement redaktori nav atbildīgi par jebkādiem miesas bojājumiem vai īpašuma bojājumiem, kas radušies šīs vietnes lietošanas rezultātā.
Alkohola pārmērīga lietošana ir viens no biežākajiem aknu bojājumu cēloņiem un izraisa alkohola aknu slimību (ALD) attīstību.
Eiropā reģistrēti augstākie saslimstības un mirstības rādītāji no aknu cirozes (AK), kas ir tieši atkarīgi no alkohola lietošanas līmeņa (līdz 9,8 l - PVO, 1995). Saskaņā ar Krievijas Federācijas Valsts statistikas komitejas datiem (1998) alkohola patēriņš ir 13 litri uz vienu cilvēku gadā. Pašlaik Krievijā ir aptuveni 10 miljoni pacientu ar hronisku alkoholismu. Neskatoties uz garīgo un fizisko atkarību no alkoholisko dzērienu lietošanas, ALD attīstās 12-20% gadījumu. Tajā pašā laikā 80% nāves gadījumu ir saistīti ar pārmērīgu alkohola un tā toksisko aizstājēju lietošanu, izraisot smagu somatisku patoloģiju (aknu koma, akūta sirds mazspēja, kuņģa-zarnu trakta asiņošana, infekcijas u.c.). Regulāru alkohola lietošanu pavada arī paaugstināts negadījumu, traumu un saindēšanās risks.
Izstrādājot ALD, alkoholiskā dzēriena veidam nav nozīmes - nosakot alkohola dienas devu, konversija tiek veikta pēc etanola gramu skaita dienā (atbilstība starp 10 ml etanola, 25 ml degvīna, 100 ml vīna, 200 ml alus). Ikdienā lietojot riskantas alkohola devas vairāku gadu garumā, attīstās alkoholiskā taukaino aknu deģenerācija (AFLD), ar ikdienas kritisko (bīstamo) etanola devu lietošanu veidojas alkoholiskais steatohepatīts (ASH). Pārvēršanās par cirozi ir iespējama, katru dienu uzņemot 160 g vai vairāk etanola 7-18% pacientu (Penquino I, II).
Jautājums par veselībai nekaitīgu alkoholu saturošu dzērienu devām ir strīdīgs. Nosakot drošas sadzīves alkohola lietošanas robežas, netiek ņemtas vērā ģenētiskās īpašības, individuālā jutība, nacionālās tradīcijas u.c.. Tajā pašā laikā alkohola lietošanas izraisīto slimību diagnosticēšanai svarīgāk ir nenoteikt alkohola devas. dzērienus, bet gan konstatēt to lietošanas regularitātes faktu, ko pavada hroniskas alkohola intoksikācijas (HAI) simptomu attīstība, kas palielina bezalkoholiska rakstura slimību attīstības risku un pasliktina to gaitu. Alkohola slimība bieži attīstās, apvienojot gan garīgās patoloģijas pazīmes, gan daudzu sistēmu un orgānu bojājumus.
ALD attīstības riska faktori ir: alkohola devas, ļaunprātīgas izmantošanas raksturs un ilgums; etanolu metabolizējošo enzīmu ģenētiskais polimorfisms; dzimums (sievietēm ir lielāka tendence attīstīties ALD); nepietiekams uzturs (uzturvielu trūkums); hepatotoksisku zāļu lietošana, kas metabolizējas aknās; infekcija ar hepatotropiskiem vīrusiem; imūnie faktori.
Etanola metabolisms. Cilvēka organismā alkohola metabolisms notiek trīs posmos, piedaloties alkohola dehidrogenāzei (ADH), mikrosomālajai etanola oksidācijas sistēmai (MEOS) un piroksisomām. ALD veidošanās lielā mērā ir saistīta ar gēnu klātbūtni, kas kodē enzīmus, kas iesaistīti etanola metabolismā - ADH un aldehīda dehidrogenāzi (AlDH). Šie fermenti ir stingri specifiski un lokalizēti galvenokārt aknās. Nokļūstot kuņģī, 12-25% no organismā ievadītā alkohola kuņģa ADH ietekmē oksidējas, kas pārvērš etanolu acetaldehīdā, tādējādi samazinot alkohola daudzumu, kas nonāk portāla asinsrites sistēmā un attiecīgi aknās. . Zemākā kuņģa ADH aktivitāte sievietēm nekā vīriešiem daļēji izskaidro faktu, ka viņas ir jutīgākas pret alkohola toksisko iedarbību. Lietojot H2-histamīna receptoru blokatorus, jāņem vērā kuņģa ADH līmeņa pazemināšanās, kas var izraisīt ievērojamu alkohola koncentrācijas palielināšanos asinīs.
Etanols, nonākot portāla asinsrites sistēmā aknās, tiek pakļauts ADH aknu frakcijai, kuras koenzīms ir nikotīnamīda dinukleotīds (NAD+), kā rezultātā veidojas acetaldehīds, kam ir svarīga loma ALD attīstībā. un koenzīma samazināšana līdz NAD*H. ADH, kas ir citoplazmas enzīms, ir iesaistīts etanola oksidēšanā pie audu spirta koncentrācijas, kas nepārsniedz 10 mmol/l.
Cilvēkiem ir trīs galvenie gēni, kas kodē ADH: ADH1, ADH2, ADH3. Polimorfismi ADH2 lokusā, visticamāk, rada būtiskas atšķirības etanola metabolismā. Tādējādi ADHb2 izoenzīms (ADG2*1 alēle), kas nodrošina pastiprinātu acetaldehīda veidošanos, biežāk sastopams mongoloīdu rases cilvēkiem, kas izskaidro viņu zemāku toleranci pret alkoholu, kas izpaužas kā sejas piesarkums, svīšana, tahikardija, kā arī atklāj iemeslus lielākam ALD attīstības riskam. Nākamajā posmā acetaldehīds tiek metabolizēts par etiķskābi citosola AlDH1 un mitohondriju AlDH2 enzīmu ietekmē NAD atkarīgās reakcijās. Gludā endoplazmatiskā tīkla mikrosomās ar MEOS palīdzību metabolizējas aptuveni 10-15% etanola, tostarp citohroma P 450 2E1, un šeit notiek arī daudzu zāļu metabolisms. Alkohola slodzes palielināšanās izraisa paaugstinātu jutību pret zālēm, toksisku metabolītu veidošanos un toksiskus aknu bojājumus, lietojot zāļu terapeitiskās devas. Visbeidzot, piroksisomās esošās katalāzes var būt iesaistītas arī etanola metabolismā.
Patoģenēze. Etanola toksiskā iedarbība ir tieši atkarīga no acetaldehīda un acetāta koncentrācijas asinīs. Etanola oksidēšanās laikā palielinās koenzīma NAD+ patēriņš, palielinās NAD*H / NAD+ attiecība, kam ir svarīga loma taukaino aknu veidošanā. NAD*H koncentrācijas palielināšanās izraisa glicero-3-fosfāta sintēzes palielināšanos, veicina taukskābju esterificēšanu, triglicerīdu sintēzi, ko pavada taukskābju b-oksidācijas ātruma samazināšanās. , kas noved pie to uzkrāšanās aknās.
Acetaldehīdam ir hepatotoksiska iedarbība, kas izpaužas kā pastiprināti lipīdu peroksidācijas (LPO) procesi, savienojumu veidošanās ar citiem proteīniem un fermentiem, kas izraisa fosfolipīdu šūnu membrānu darbības traucējumus. Acetaldehīda savienojumu komplekss ar olbaltumvielām, ieskaitot tubulīnu, izraisa izmaiņas hepatocītu mikrotubulu struktūrā, veidojot tā saukto alkoholisko hialīnu, kā arī veicina intracelulārā transporta traucējumus, olbaltumvielu un ūdens aizturi un hepatocītu balonu deģenerācijas attīstību. .
Pārmērīga acetaldehīda un taukskābju veidošanās izraisa mitohondriju enzīmu aktivitātes samazināšanos, oksidācijas un fosforilācijas procesu atdalīšanu, adenozīna trifosfāta sintēzes samazināšanos, kā arī palielina citokīnu sintēzi (jo īpaši transformējošā augšanas faktora - TGFb). ). Pēdējais veicina Ito šūnu transformāciju fibroblastos, kas ražo kolagēnu. Vēl viens kolagēna veidošanās mehānisms ir Kupfera šūnu stimulēšana ar lipīdu peroksidācijas produktiem.
Līdz ar to tiek pieņemts, ka angiotenzinogēna gēns (AGT), olbaltumviela, kas sintezēts aknās, un angiotenzīns II spēlē lomu ALD attīstībā. Tika konstatēts to profibrogēnais efekts, konstatēts angiotenzīna II līmeņa paaugstināšanās žurku plazmā atkarībā no alkohola motivācijas.
Imūnmehānismiem ir nozīmīga loma ALD patoģenēzē. Tika atklāti humorālās imunitātes pārkāpumi: seruma imūnglobulīnu līmeņa paaugstināšanās (galvenokārt A imūnglobulīnu klase), to nogulsnēšanās aknu sinusoīdu sieniņās, zemu antinukleāro un pretgludo muskuļu antivielu titru veidošanās, kā arī antivielas pret alkoholiskiem. hialīns utt.
Šūnu imunitātes pārkāpums ir saistīts ar T šūnu sensibilizāciju ar acetaldehīdu, imūnkompleksu ietekmi un pastiprinātu citotoksisko T limfocītu veidošanos. Imūnkompetento šūnu mijiedarbības rezultātā izdalās pro-iekaisuma citokīni (tostarp audzēja nekrozes faktors – TNFa) un tā inducētie interleikīni (IL-1, IL-2, IL-6, IL-8), kas ar reaktīvo skābekļa sugu un slāpekļa oksīda līdzdalība izraisa dažādu mērķa šūnu bojājumus un galu galā vairāku orgānu traucējumu attīstību.
Tajā pašā laikā pacientiem, kuri cieš no ALD, tiek konstatēta pārmērīga baktēriju augšana tievajās zarnās, kas veicina endotoksīna, gramnegatīvo mikrobu membrānas lipopolisaharīda, sintēzes palielināšanos. Endotoksīns, nonākot portāla sistēmas asinīs kopā ar citiem negatīviem faktoriem (LPO metabolītiem), stimulē Kupfera šūnu aktivitāti, pro-iekaisuma citokīnu sintēzi, īpaši TNFa, kuru aktīvā iedarbība veicina iekaisuma un iekaisuma attīstību un attīstību. fibrozes procesi aknās.
CAI diagnostika. Alkohola reibuma smaguma novērtēšanai ir liela medicīniska un sociāla nozīme. Būtisks arguments ir pasaules statistikas dati: mirstība alkohola reibuma dēļ ieņem trešo vietu.
Lai identificētu CAI masu pārbaudes laikā, tiek izmantota pasaulē slavenā GAGE anketa, kas sniegta zemāk.
- Vai jums kādreiz ir šķitis, ka jums vajadzētu samazināt dzeršanu?
- Vai tevi kaitināja, ja kāds no apkārtējiem (draugi, radinieki) stāstīja par nepieciešamību samazināt dzeršanu?
- Vai esat kādreiz piedzīvojis vainas sajūtu, kas saistīta ar alkohola lietošanu?
- Vai jums kādreiz ir bijusi vēlme dzert alkoholu, tiklīdz pamodāties pēc dzeršanas?
Pozitīvu atbilžu klātbūtne uz visiem četriem jautājumiem ļauj izdarīt secinājumu par sistemātisku alkohola lietošanu un nosaka skrīninga augsto specifiku.
Lai novērtētu CAI smagumu, tika piedāvāta anketa par “pēcintoksikācijas alkohola sindromu” (PAS), kurā uzskaitīti CAI simptomi.
- Nemiers un uztraukums.
- Bālums (auksta un mitra āda).
- Sāpes sirds rajonā.
- Hiperēmija (pārmērīgs sejas apsārtums).
- Galvassāpes.
- Reibonis.
- Pirkstu trīce.
- Vēlme lietot alkoholu.
- Ādas dzeltenums.
- Ādas jutīguma izmaiņas (paaugstināšanās, samazināšanās).
- Nenormāla zarnu kustība (caureja, aizcietējums).
- Nelabums un nogurums.
- Nervu spriedze.
- Deguna asiņošana.
- Ģībšanas stāvokļi.
- Aizdusa.
- Pietūkums kājās.
- Sejas pietūkums.
- Apetītes trūkums.
- Sirdsdarbības sajūta.
- Pārtraukumi sirds darbībā.
- Paaugstināta siekalošanās.
- Nepieciešamība smēķēt.
- Nepieciešamība lietot zāles.
- Atmiņas zudums par notikumiem, kas notika iepriekšējā dienā.
- Aizkaitināmība un dusmas.
- Vemšana un slikta dūša.
- Vemšana ir asiņaina.
- Samazināta seksuālā vēlme.
- Sausa mute.
- Ādas izsitumi.
- Pārmērīga apetīte.
- Pārmērīgas slāpes.
- Pārmērīga svīšana (nakts svīšana).
- Nestabila gaita.
Pārbaudot pacientus Krievijas Federācijas Veselības un sociālās attīstības ministrijas Narkoloģijas pētniecības institūta klīnikas narkoloģijas nodaļā, 15 vai vairāk pozitīvas atbildes uz PAS anketu liecināja par lielu varbūtību sistemātiski lietot nedrošas alkohola devas. - kas satur dzērienus.
Lai identificētu CAI fiziskos simptomus, tiek izmantots “LeGo Grid”. Tā kā nav specifisku KAI pazīmju, izmeklējot pacientu, jāņem vērā ar vecumu saistītu izmaiņu (neiroloģisku, garīgu u.c.) un līdzīgu KAI simptomu un blakusslimību raksturojums. Septiņu vai vairāk objektīva fizisko simptomu novērtējuma pazīmju klātbūtne neizslēdz CAI iespējamību izmeklētajam pacientam. Šeit ir KhAI fizisko pazīmju saraksts (“LeGo Grid”, 1976), ko modificējuši O. B. Žarkovs, P. P. Ogurcovs, V. S. Moisejevs.
- Aptaukošanās.
- Ķermeņa svara trūkums.
- Pārejoša arteriālā hipertensija.
- Trīce.
- Polineiropātija.
- Muskuļu atrofija.
- Hiperhidroze.
- Ginekomastija.
- Pieauss dziedzeru paplašināšanās.
- Pārklāta mēle.
- Kam ir tetovējums.
- Dupuitrena kontraktūra.
- Konjunktīvas venozais sastrēgums.
- Sejas hiperēmija ar ādas kapilāru tīkla paplašināšanos.
- Hepatomegālija.
- Telangiektāzija.
- Palmāra eritēma.
- Traumu, apdegumu, kaulu lūzumu, apsaldējumu pēdas.
CAI laboratoriskā diagnostika. Pacientiem, kuri pārmērīgi lieto alkoholu biežāk nekā populācijā, tiek konstatēts: vidējā eritrocītu tilpuma, dzelzs līmeņa paaugstināšanās serumā, leikocitoze, aspartātaminotransferāzes (AST) aktivitātes pārsvars pār alanīna aminotransferāzes (ALAT) aktivitāti (66). %), paaugstināta sārmainās fosfatāzes (ALP) aktivitāte (24%) un γ-glutamiltranspeptidāze (γ-GT) (70-80%), triglicerīdu saturs (70-80%), holesterīns (70-80%), imūnglobulīnu klase A (60-70%). Tomēr starp parastajām laboratorijas diagnostikas metodēm nav īpašu testu, kas norādītu uz CAI. Pēdējos gados specializētās klīnikās, lai identificētu pārmērīgu alkohola lietošanu, tiek izmantota ogļhidrātu deficīta (desializēta) transferīna noteikšana asins serumā - transferīna savienojums ar acetaldehīdu, kas izraisa dzelzs uzkrāšanos aknās (70 -90%) un ar acetaldehīdu modificētu hemoglobīnu (70-80%).
Klīniskā aina. ALD klīniski izpaužas vairāku nosoloģisko formu veidā (saskaņā ar ICD - 10): taukainās aknas (K 70,0), akūts vai hronisks hepatīts (K 70,1), alkoholiskā fibroze (K 70,2) un aknu ciroze (K). 70.3).
ZhDP parasti notiek asimptomātiski un tiek atklāts nejauši izmeklējuma laikā, kad tiek konstatēta hepatomegālija, vai pēc ultraskaņas, kas fiksē izteiktu ehogenitātes pieaugumu un asinsvadu struktūru redzamības pavājināšanos. Pacientu sūdzības par diskomfortu un smaguma sajūtu labajā hipohondrijā nav saistītas ar patoloģisku procesu aknās un ir izskaidrojamas ar citiem iemesliem. Palpējot, aknas ir palielinātas, gludas ar noapaļotu malu. Bioķīmiskie testi parasti ir bez novirzēm; Var novērot vieglu citolīzes sindromu. Neskaidros gadījumos tiek veikta aknu punkcijas biopsija.
Alkoholiskais hepatīts. Ir akūtas un hroniskas alkohola hepatīta formas.
Akūts alkoholiskais hepatīts (AAH) ir akūta progresējoša deģeneratīvi-iekaisuma aknu slimība. OAS klīniskās izpausmes ir ļoti dažādas: no vieglām anikteriskām formām līdz fulminantam hepatītam, ko pavada smaga aknu mazspēja; bieži izraisa aknu komas attīstību un nāvi. OAG gaita un prognoze ir atkarīga no aknu disfunkcijas smaguma pakāpes. OAS ir īpaši grūti pēc alkohola pārmērībām uz jau izveidojušās cirozes fona. Visizplatītākā ir OAS ikteriskā forma. Pacienti sūdzas par vājumu, sliktu dūšu, anoreksiju, svara zudumu, blāvām sāpēm labajā hipohondrijā, drudzi un dzelti. Ādas nieze nav raksturīga šai alkoholiskā hepatīta formai. Retāks variants (līdz 13%) ir holestātiskā forma, ko papildina smags ādas nieze, intensīva dzelte, izkārnījumu krāsas maiņa un urīna tumšums, kam nepieciešama diferenciāldiagnoze ar obstruktīvu dzelti un, pievienojot drudzi, ar holangītu. OAS zibens forma ir letāla, zibens rakstura un atspoguļo akūtu masīvu hepatocītu nekrozi. Klīniski tas izpaužas kā strauja dzelte, augsta temperatūra, apjukums un raksturīga aknu smaka no mutes. To raksturo izkliedētas intravaskulāras koagulācijas pievienošana, attīstās nieru mazspēja, hipoglikēmija, infekciozas komplikācijas un smadzeņu tūska. Šī hepatīta forma, īpaši pacientiem ar alkoholisko cirozi, nosaka augstu nāves risku un veicina fibrozes progresēšanu OAS klīnisko simptomu regresijas gadījumos.
Īpašu vietu aknu slimību struktūrā ieņem alkohola surogātu izraisīti bojājumi, ar kuriem masveida saindēšanās tika novērota pagājušā gada vasarā un rudenī (kopējais upuru skaits uz 2006. gada 23. novembri Krievijas Federācijā bija 10 400 cilvēki). Galvenā toksiskā viela ir poliheksametilēnguanidīna hidrohlorīds, kas ir daļa no dezinfekcijas līdzekļiem. Citi iespējamie etioloģiskie faktori ir dietilftalāts, izopropilspirts, acetaldehīds utt. Katra no šīm toksiskajām vielām var izraisīt dažādu orgānu un sistēmu bojājumus. Tomēr starp tiem ļoti nozīmīga ir toksiskā hepatīta attīstība, kas rodas ar izteiktu, lēni izzūdošu holestāzi. Saindēšanās gadījumā ar alkohola surogātiem citolīzes sindroms ir mazāk raksturīgs (5-10 aminotransferāžu normas), reti tiek ietekmēta aknu sintētiskā funkcija. Visdramatiskākā situācija - progresējoša aknu mazspēja - tiek novērota pacientiem ar fona alkoholisko cirozi.
Hronisks alkohola etioloģijas hepatīts vai alkoholiskais steatohepatīts klīniskajās izpausmēs nedaudz atšķiras no ZhDP. Pacienti sūdzas par vājumu un anoreksiju. Palpācija atklāj palielinātas aknas ar noapaļotu malu. Ultraskaņā attēls atgādina kuņģa-zarnu trakta attēlu. Dažos gadījumos nedaudz palielinās liesas izmērs, paplašinās liesas vēnas un sāk parādīties portāla hipertensijas pazīmes. Laboratoriskā izmeklēšana atklāj transamināžu aktivitātes palielināšanos ar raksturīgu ASAT pārsniegumu pār ALAT; dažos gadījumos ir iespējams mērens holestāzes sindroma rādītāju pieaugums. Diagnozes pārbaude ir iespējama ar aknu morfoloģisko izmeklēšanu. Ilgstošs ASH kurss izraisa alkohola cirozes veidošanos. Iespējams, ka alkohola ciroze var veidoties bez izteiktām iekaisuma pazīmēm caur perivenulāru alkoholisko fibrozi.
Alkohola centrālais procesors. Ar alkoholisko cirozi ir iespējamas ļoti dažādas klīniskās izpausmes. Ievērojamam skaitam pacientu ciroze ir latenta vai asimptomātiska. Tomēr daudziem no viņiem pēc pārbaudes ir palielinātas aknas. Sūdzības par vājumu, dispepsijas traucējumiem, svara zudumu un locītavu sāpēm ir nespecifiskas. 75% gadījumu cirozei raksturīgs attēls veidojas mazu aknu pazīmju veidā - telangiektāzija, palmu eritēma, ginekomastija. Aknas, kā likums, ir palielinātas, sablīvētas, ar gludu virsmu, mala ir smaila; dažos gadījumos aknas ir normālas vai samazinātas. Var būt mērens liesas izmēra pieaugums, portāla un liesas vēnu paplašināšanās, portāla asinsrites ātruma samazināšanās (portāla hipertensijas izpausme) ar sekojošu barības vada varikozu vēnu veidošanos. Ar KP dekompensāciju un tūskas-ascītiskā sindroma attīstību tiek konstatēti elektrolītu traucējumi - hipokaliēmiskā alkaloze, 33% pacientu - metaboliskā alkaloze, hiponatriēmija un tiek konstatēts amonjaka līmeņa paaugstināšanās asinīs. Encefalopātija ir jaukta rakstura, var attīstīties koma. Bioķīmiskā asins analīze atklāj hiperbilirubinēmiju, sārmainās fosfatāzes un γ-GT, ASAT un ALAT aktivitātes palielināšanos ne vairāk kā 6 reizes. Attīstās trombocitopēnija, protrombīna laika pagarināšanās un hipoalbuminēmija. Alkohola etioloģiju var apstiprināt, pētot alkohola vēsturi, izslēdzot cirozes vīrusu raksturu.
ALD bieži pavada hronisks pankreatīts, perifēra polineiropātija, miokardiopātija un nefropātija. Novērtējot slimības klīnisko ainu un gaitu, jāņem vērā, ka orgānu patoloģijas progresēšanu nosaka ne tikai akūtas un hroniskas alkohola intoksikācijas ietekme, bet arī abstinences sindroma patoloģiskās izpausmes.
Pie ALD morfoloģiskajiem kritērijiem pieder tauku infiltrācija (smalki un lieli pilieni acinusa 2. un 3. zonā), hepatocītu balonu deģenerācija, acidofīlie ķermeņi - Mallory ķermeņi vai alkoholiskais hialīns kondensētu mikrofilamentu veidā, milzu mitohondriji, kolagenizācija. 3. zonas (perivenulārā fibroze), neitrofilā infiltrācija, tubulārā holestāze, palielināta hemosiderīna nogulsnēšanās aknās (att.).
ALD prognoze. Lai noteiktu alkohola hepatīta smagumu un dzīvildzi, tiek izmantots Madrija indekss, kas aprēķināts kā 4,6 x (starpība starp pacienta protrombīna laiku un to pašu rādītāju kontrolē) + seruma bilirubīns mg%. Nāves varbūtība ar Maddray indeksa vērtību, kas pārsniedz 32, pārsniedz 50%.
Pēdējos gados OAG iznākuma mirstības riska novērtēšanai tiek izmantota MELD (Model for End-Stage Liver Disease) sistēma – beigu stadijas aknu slimības modelis, kas iepriekš izstrādāts pacientiem, kuriem nepieciešama aknu transplantācija. lai noteiktu operācijas laiku. MELD (punktos) aprēķina, izmantojot formulu: 10 x (0,957 x loge[kreatinīna mg/dl] + 0,378 x loge[protrombīna laiks] + 0,643 x cirozes etioloģija). Ir pierādīts, ka ar punktu skaitu līdz 40, paredzamais dzīves ilgums ir ierobežots līdz 3 mēnešiem.
ASG ārstēšana. ASH terapijas mērķis ir novērst fibrozes un cirozes veidošanos (iekaisuma un fibrozes inhibēšana aknu audos, lipīdu peroksidācijas procesu aktivitātes un bioķīmisko parametru samazināšana, toksisko metabolītu izvadīšana, endotoksēmijas mazināšana), uzlabojot dzīves kvalitāti un ar ASH saistītu stāvokļu ārstēšana (hronisks holecistīts, pankreatīts, kuņģa un divpadsmitpirkstu zarnas čūlaina slimība utt.).
Etanols ir galvenais etioloģiskais faktors slimības attīstībā. ALD ārstēšanas pamatā jābūt pilnīgai atturībai no alkohola lietošanas. Ja šis nosacījums ir izpildīts, HDP, ASG gadījumā ir iespējama hroniskas aknu slimības simptomu regresija un laboratorisko rādītāju uzlabošanās. Ilgstoša atturēšanās no alkohola cirozes palīdz uzlabot aknu proteīnu sintētisko funkciju, samazina portāla hipertensijas izpausmes, kā arī uzlabo morfoloģisko ainu. Nepieciešams veikt sistemātiskas sarunas ar pacientiem, kuriem ir CAI pazīmes, un viņu tuviem līdzstrādniekiem, argumentējot alkohola ietekmi uz somatoneiroloģiskās patoloģijas rašanos, alkohola atkarības un garīgo slimību attīstību, bīstamas saindēšanās risku, kā arī smagu seku iespējamība narkotiku un alkoholisko dzērienu mijiedarbības rezultātā (īpaši gados vecākiem cilvēkiem).
Vēlams ieviest starptautiski pieņemtus alkohola tirdzniecības ierobežojumus un veikt izglītojošu darbu.
Diēta. ALD gadījumā vēlams nozīmēt olbaltumvielām bagātu (vismaz 1 g uz 1 kg ķermeņa svara), ar augstu enerģētisko vērtību (vismaz 2000 kcal/dienā), ar pietiekamu vitamīnu saturu (īpaši grupai). B, folijskābes un lipoīnskābes) un mikroelementi - cinks, selēns.
Konstatēts, ka cinka deficīts (40% pacientu ar B un C cirozi pēc Child-Pugh) ne tikai pastiprina aknu encefalopātijas izpausmes, bet pats par sevi ir aknu mazspējas pazīme. Ir arī zināms, ka ADH ir no cinka atkarīgs enzīms, kas iesaistīts etanola metabolismā.
Jāpatur prātā, ka alkohola lietotājiem parasti ir mazs svars, tāpēc pakāpeniski palielinot olbaltumvielu uzņemšanu ar pārtiku, uzlabojas aknu darbība, kas izskaidrojams ar enzīmu stimulāciju, katabolisko procesu samazināšanos un imūnsistēmas stāvokļa normalizēšanos.
Zāļu terapija ALD ārstēšanai. ALD patoģenēzē galvenā loma ir bioloģisko membrānu bojājumiem un enzīmu sistēmu disfunkcijai. Šajā sakarā polinepiesātināto (būtisko) fosfolipīdu izmantošana, kam piemīt membrānas stabilizējošas un citoprotektīvas īpašības, aizvieto fosfolipīdu defektus bojāto aknu šūnu membrānu struktūrās, integrējot fosfolipīdu kompleksus citoplazmas membrānās, palielina membrānu aktivitāti un plūstamību, kā arī normalizē. lipīdu peroksidācijas procesi. Divdesmit gadus ilgā pētījumā, kas bija veltīts esenciālo fosfolipīdu ietekmes uz alkoholisko aknu bojājumu izpētei, izmantojot eksperimentālu modeli - paviāniem pērtiķiem, tika parādīts slimības progresēšanas palēninājums, novēršot tās pāreju uz cirozes stadiju. Essentiale ordinē devā 500-1000 mg/dienā intravenozi 10-14 dienas, pēc tam ārstēšanas kursu turpina 3-6 mēnešus ar devu 1800 mg/dienā. Plašā pieredze būtisku fosfolipīdu lietošanā ir apstiprinājusi zāļu augsto efektivitāti, ārstējot pacientus ar neaktīvām ALD formām - JDP, ASH.
Silimarīna preparātus (silibinīns ir galvenā aktīvā viela) diezgan plaši izmanto aknu steatozes un hroniska alkohola hepatīta ārstēšanā. Silimarīnam ir hepatoprotektīvs un antitoksisks efekts (70-105 mg/dienā vismaz 3 mēnešus). Tās darbības mehānisms ir saistīts ar lipīdu peroksidācijas nomākšanu, kā rezultātā tiek novērsti šūnu membrānu bojājumi. Bojātos hepatocītos zāles stimulē proteīnu un fosfolipīdu sintēzi, kā rezultātā hepatocītu membrānas stabilizējas. Tika atzīmēts silimarīna antifibrotiskais efekts. Eksperimentālie modeļi parādīja aknu audu fibrotiskās transformācijas ātruma palēnināšanos tā ietekmē, kas ir saistīts gan ar brīvo radikāļu klīrensa palielināšanos, gan tiešu kolagēna sintēzes nomākšanu.
Ademetionīnu lieto alkohola izraisītu aknu bojājumu ārstēšanai. Ademetionīna lietošana ALD ir saistīta ar nepieciešamību organismam papildināt endogēno ademetionīnu, kas veic vienu no galvenajām funkcijām starpposma metabolismā. Kā tādu svarīgu savienojumu kā cisteīna, taurīna, glutationa un koenzīma A prekursors ademetionīns aktīvi piedalās transaminācijas, transsulfurācijas un aminopropilēšanas reakcijās. Eksogēnā ademetionīna izmantošana ļauj samazināt toksisko metabolītu uzkrāšanos un negatīvo ietekmi uz hepatocītiem, stabilizēt šūnu membrānu viskozitāti un aktivizēt ar tiem saistīto enzīmu darbību. No otras puses, ademetionīns uzlabo membrānu un ceļu metilēšanu, veicina membrānas viskozitātes izmaiņas, uzlabo neironu receptoru darbību, stabilizē mielīna apvalku un, iekļūstot hematoencefālisko barjerā, stabilizē fosfalīnerģisko un serotonīnerģisko sistēmu darbību. Hepatoprotektīvo un antidepresantu īpašību kombinācija nosaka zāļu lietošanu depresīviem traucējumiem toksisku aknu bojājumu gadījumos. Ieteicamās ademetionīna devas ir 800 mg dienā parenterālai ievadīšanai (2 nedēļas) un 1600 mg dienā perorālai ievadīšanai (no 2 līdz 4-8 nedēļām).
Kopš 2005. gada vietējās zāles ademetionīns Heptor sāka lietot pacientiem ar alkohola izraisītu kuņģa-zarnu trakta, ASG un ADC. Lietojot dienas devu 1600 mg per os, Heptor izraisa somatisko un autonomo izpausmju samazināšanos, bioķīmiskās aktivitātes rādītāju samazināšanos pēc 2 nedēļu lietošanas, tam ir līdzīgs drošības profils un zems blakusparādību biežums, kam nav nepieciešama deva. samazinājums vai pārtraukšana, salīdzinot ar oriģinālajām zālēm. Heptor unikālās īpašības ļauj to izmantot klīniskajā praksē alkohola, toksisku, zāļu izraisītu aknu bojājumu un depresīvu stāvokļu ārstēšanai. Heptor ir labi panesams, tāpēc var ieteikt atkārtotus kursus.
Lietojot ursodeoksiholskābes (UDCA) zāles pacientiem ar ALD, tika novērota klīniskā, bioķīmiskā un histoloģiskā attēla uzlabošanās. Tas, iespējams, ir saistīts ne tikai ar tā citoprotektīvo, antiholestātisko, antiapoptotisko iedarbību, bet arī ar proinflammatorisko citokīnu sekrēcijas nomākšanu. ALD gadījumā UDCA tiek nozīmēts devā 13-15 mg/kg/dienā.
Kortikosteroīdu hormonu lietošanas ieteicamība ALD gadījumā ir pretrunīga. Tomēr lielākajā daļā randomizēto pētījumu ir iegūti dati par būtisku mirstības samazināšanos, lietojot 40 mg prednizolona vai 32 mg Metipred 4 nedēļas pacientiem ar smagu OAS.
Ņemot vērā pro-iekaisuma citokīnu lomu OAG patoģenēzē, himērisko antivielu pret TNFa (Infliksimabs, 5 mg/kg) lietošana ir pamatota, ko ticami pavada klīnisko un laboratorisko parametru regresija salīdzinājumā ar prednizolonu.
Tam pašam mērķim pentoksifilīnu lieto kā TNFa inhibitoru (1200 mg/dienā per os 4 nedēļas), kas uzlabo dzīves kvalitāti un samazina mirstību pacientiem ar OAS.
Smagu OAG gadījumus pavada smagas aknu encefalopātijas attīstība, kuras korekcija tiek veikta, lietojot laktulozi (30-120 ml/dienā per os un/vai taisnajā zarnā) un ornitīna aspartātu (20-40 g/). IV diena pilināmā veidā līdz galveno izpausmju atvieglošanai šī komplikācija).
Antibakteriālo zāļu (3. paaudzes cefalosporīnu u.c.) lietošana pacientiem ar ALD indicēta infekcijas komplikāciju profilaksei un ārstēšanai, kā arī endotoksēmijas mazināšanai.
Izvēles ārstēšana zibenīgai OAS var būt aknu transplantācija.
Patoģenētiski pamatota dažādu ALD nosoloģisko formu ārstēšanā ir antioksidantu (selēna, betaīna, tokoferola u.c.) lietošana. Tomēr to efektivitāte nav pierādīta.
Lai ietekmētu endogēno toksēmiju, kas saistīta ar tievās zarnas bakteriālo piesārņojumu, pacientiem ar alkoholisko aknu steatozi un ASH ārstēšanas programmā vēlams iekļaut prebiotiku lietošanu, kas uzlabo zarnu baktēriju metabolismu. Prebiotisko zāļu ietekmē pacientiem ar kompensētu alkohola etioloģijas cirozi tika novērota pārmērīgas baktēriju proliferācijas samazināšanās tievajās zarnās, ko papildināja aknu encefalopātijas smaguma samazināšanās.
Literatūra
- Ivaškins V.T., Mayevskaya M.V. Alkohola-vīrusu aknu slimības. M.: Litterra, 2007. 160 lpp.
- Stickl F., Osterreicher C. Ģenētisko polimorfismu loma alkohola aknu slimībā // Alkohols un alkoholisms. 2006. gads; 41(3): 209-222.
- Zima T. Etanola metabolisms un toksiskā iedarbība // Ceska a slovenska gastroenterol a hepatol. 2006. gads; 60(1): 61-62.
- Bataller R., North K., Brenner D. Ģenētiskie polimorfismi un aknu fibrozes progresēšana: kritisks novērtējums // Hepatol. 2003. gads; 37(3): 493-503.
- Rusakova O. S., Garmash I. V., Gushchin A. E. et al. Alkoholiskā aknu ciroze un alkohola dehidrogenāzes (ADH2) un angiotenzinogēna (T174M, M235T) ģenētiskais polimorfisms // Klīniskā farmakoloģija un terapija. 2006. Nr.5. 31.-33.lpp.
- Kotovs A.V., Tolpygo S.M., Pevtsova E.I., Obukhova M.F. Alkohola motivācija žurkām: diferencēta angiotenzīnu līdzdalība // Eksperimentālā narkoloģija. 2004. Nr.6. 37.-44.lpp.
- Ogurcovs P. P., Nuzhny V. P. Hroniskas alkohola intoksikācijas ekspresdiagnostika (skrīnings) somatiskiem pacientiem // Klīniskā farmakoloģija un terapija. 2001. Nr.1. 34.-39.lpp.
- Ivaškins V.T., Bueverovs A.O. Toksisks hepatīts, ko izraisa saindēšanās ar alkohola aizstājējiem // Krievijas Gastroenteroloģijas, hepatoloģijas, koloproktoloģijas žurnāls. 2007. Nr.1. P. 4-8.
- Dunn W., Jamil L. H., Brown L. S. u.c. MELD precīzi prognozē mirstību pacientiem ar alkohola hepatītu // Hepatol. 2005. gads; 41(2): 353-358.
- Makhovs V.M. Alkohola izcelsmes gremošanas orgānu sistēmiskā patoloģija // Ross. Mīļā. Žurnāls, lietotnē. "Gremošanas sistēmas slimības." 2006. Nr.1. P. 5-13.
- Achord J. L. Alkoholiskā hepatīta pārskats un ārstēšana: metaanalīze, kas pielāgojas neskaidriem mainīgajiem // Gut. 1995. gads; 37: 1138-1145.
- Bueverovs A. O., Mayevskaya M. V., Ivashkin V. T. Diferencēta pieeja alkohola aknu bojājumu ārstēšanai // Russian Journal of Gastroenterology, Hepatology, Coloproctology. 2005. Nr.5. P. 4-9.
- Otake H. Aknu cirozes klīnisko kritēriju diagnostikas problēmas - laparoskopijas skatījumā // Gastroenterols. 2000; 31: 165-174.
- Khazanovs A.I. Svarīga mūsu laika problēma ir alkohola aknu slimība // Russian Journal of Gastroenterology, Hepatology, Coloproctology. 2003. Nr.3. 13.-20.lpp.
- Šapošņikova N. A., Drozdovs V. N., Petrakovs A. V., Ilčenko L. Yu. Cinka deficīts un aknu encefalopātija pacientiem ar aknu cirozi // Gastroenterols. starpresoru sestdien / red. Ju. O. Filippova. Dņepropetrovska, 2007. Izdevums. 38. 191.-196.lpp.
- Plevris J. N., Hayes P. C., Bouchier I. A. D. Ursodeoksiholskābe alkohola aknu slimību ārstēšanā. Gastroenterols // Hepatols. 1991. gads; 3: 6536-6541.
- Bueverovs A. O. Ursodeoksiholskābes vieta alkohola aknu slimību ārstēšanā // Gastroenteroloģijas un hepatoloģijas klīniskās perspektīvas. 2004. Nr.1. 15.-20.lpp.
- Maddrijs V., Bronbeks M., Bedīne M. u.c. Alkoholiskā hepatīta kortikosteroīdu terapija // Gastroenterols. 1978. gads; 75: 193-199.
- C diena. Alkoholiskās aknu slimības // Ceska a slovenska gastroenterol. hepatols. 2006. gads; 60(1): 67-70.
- Tilg H., Jalan R., Kaser A. u.c. Pretvēža nekrozes faktora alfa monoklonālo antivielu terapija smaga alkohola hepatīta gadījumā // Hepatol. 2003. gads; 38: 419-425.
- Spahr L., Rubbia-Brandt l., Frossard J.-L. un citi. Steroīdu kombinācija ar ifliksimabu vai placebo smaga alkohola hepatīta gadījumā: randomizēts kontrolēts izmēģinājuma pētījums // Hepatol. 2002. gads; 37: 448-455.
- Naveau S., Chollet-Martin S., Dharancy P. et al. Dubultakls randomizēts kontrolēts pētījums par ifliksimabu, kas saistīts ar prednizolonu akūtā alkoholiskā hepatīta gadījumā // Hepatol. 2004. gads; 39: 1390-1397.
- Acriviadise, Bolta R., Briggs W. et al. Pentoksifilīns uzlabo īstermiņa izdzīvošanu smaga akūta alkohola hepatīta gadījumā: dubultmaskēts, placebo kontrolēts pētījums // Gastroenterols. 2000; 119: 1637-1648.
- Ilchenko L. Yu., Topcheeva O. N., Vinnitskaya E. V. et al.. Encefalopātijas klīniskie aspekti pacientiem ar hroniskām aknu slimībām. Consilium medicum., lietotnē. "Gastroenteroloģija". 2007. Nr.1. 23.-28.lpp.
- Lucey M. Vai aknu transplantācija ir piemērota alkohola hepatīta ārstēšana? // Hepatols. 2002. gads; 36: 829-831.
- O'Shea R., McCullough A. J. Steroīdi vai kokteiļi alkohola hepatīta ārstēšanai // Hepatol. 2006. gads; 44: 633-636.
- Bogomolovs P. O., Petrakovs A. V., Kuzmina O. S. Aknu encefalopātijas korekcija: patofizioloģiskais pamats prebiotiku lietošanai // Grūts pacients. 2006. Nr.7. 37.-40.lpp.
L. Ju. Iļčenko, Medicīnas zinātņu doktors, profesors
RGMU, Maskava
Pirmās pazīmes attīstās diezgan vēlu, tāpēc ne vienmēr ir iespējams laikus diagnosticēt slimību.
Sieviešu vidū
Daudzi pētījumi liecina, ka sievietēm alkohola pārmērīgas lietošanas dēļ ātrāk attīstās aknu iekaisums. Tas izskaidrojams ar alkohola dehidrogenāzes enzīma atšķirīgo aktivitāti vīriešiem un sievietēm.
Ir zināms, ka sievietēm šī enzīma aktivitāte ir zemāka. Tas ietekmē etanola sadalīšanās ātrumu sievietes ķermenī. Tāpēc pirmās pazīmes sievietēm parādās daudz agrāk.
Tādējādi vispirms izpaužas astenoveģetatīvs sindroms. Tālāk nāk drudzis. Ādas un gļotādu dzeltenā daļa padodas dzeltenai.
Vīriešiem
Vīriešiem raksturīgie simptomi ir ginekomastija - piena dziedzeru palielināšanās.
Turklāt tiek pievienots astenoveģetatīvs sindroms: apetītes zudums (sakarā ar augstu alkohola kaloriju saturu), vispārējs nogurums un vājums. Tāpat kā sievietēm, arī vīriešiem aptaukošanās ir papildu riska faktors deģeneratīvu izmaiņu attīstībai.
Asins analīze
Aizdomās par alkoholisko hepatītu var rasties jau asins analīžu rezultātu iegūšanas stadijā. Ilgstoši lietojot alkoholu, vispārējā asins analīze mainīs ESR indikatoru tā pieauguma virzienā.
Retikulocītu skaits palielinās, un hemoglobīns, gluži pretēji, samazinās. Iespējama neliela trombocitopēnija.
Bioķīmiskajā asins analīzē uzmanība tiek pievērsta aknu testu rezultātiem. Ir ievērojams kopējā bilirubīna pieaugums un tiešā bilirubīna samazināšanās.
Palielinās ASAT, ALAT, sārmainās fosfatāzes, LDH un timola testa daudzums. Analizējot lipīdu profilu, jūs ievērosiet, ka tā alkoholiskā hepatīta rādītāji ir pie normas apakšējās robežas.
Vispārējs urīna tests parādīs sārmainu vidi (parasts urīns ir nedaudz skābs). Urīnā būs palielināts olbaltumvielu, leikocītu, epitēlija un sarkano asins šūnu daudzums.
Izrakstītās zāles
Papildus vispārīgajiem ieteikumiem, ko mēs aprakstījām iepriekš, pacientam, kuram diagnosticēts alkoholiskais hepatīts, ir indicēta zāļu terapija. Smagos gadījumos tiek nozīmēti kortikosteroīdi: prednizolons vai budezonīds. Pēdējam ir mazāk blakusparādību.
Pēc 7 dienām tiek aprēķināts Lille indekss - rādītājs, kas parāda steroīdu terapijas efektivitāti. Ja Lille indekss ir mazāks par 0,45, tad zāles turpina 28 dienas, pēc tam to pārtrauc 2 nedēļu laikā.
Ja indekss ir lielāks par 0,45, prednizolona lietošana tiek pārtraukta tā neefektivitātes dēļ. Pirms prednizolona izrakstīšanas ir svarīgi pārbaudīt infekciju, jo šīs zāles nomāc imūnsistēmu, un pacientam līdztekus alkoholiskā hepatīta simptomu novēršanai pastāv risks iegūt sekundāru infekciju.
Ja pacients nepanes glikokortikosteroīdus, tiek parakstīts pentoksifilīns. Šīs ir otrās līnijas zāles. Tomēr eksperimentu laikā tika konstatēts, ka tam ir labāka ietekme uz hepatorenālo simptomu mazināšanu.
Zāles N-acetilcisteīns tiek lietots kombinācijā ar glikokortikosteroīdiem. Tas palielina paredzamo dzīves ilgumu pacientiem ar alkohola hepatītu.
Ar mērenu smaguma pakāpi pacientam nav nepieciešama steroīdu terapija. Tās ārstēšana sākas ar pilnīgu atturēšanos un diētas ar augstu olbaltumvielu saturu ievērošanu.
Ir parakstītas šādas zāles:
- Ademetionīns. Tas samazina ASAT un kopējā bilirubīna līmeni un ir salīdzinoši drošs. Turklāt šīm zālēm ir antidepresants, un tās tiek parakstītas dubultā kursā.
- Būtiski fosfolipīdi - Evalar, Hepatrin. Šīs zāles kavē tauku uzkrāšanos un tām ir lipolītiska iedarbība, tas ir, tās sadala taukus aknās. Neitralizē toksīnus un veicina jaunu fosfolipīdu sintēzi.
Vieglos gadījumos pietiek ar atteikšanos no alkohola, ievērot olbaltumvielu diētu un iziet hepatoprotektoru kursu.