Элементы в периодической системе располагаются в последовательности возрастания порядковых номеров Z от 1 до 110. Порядковый номер элемента Z соответствует заряду ядра его атома, а также числу движущихся в поле ядра электронов.
Химические элементы по структуре невозбужденных атомов подразделяются на естественные совокупности, что отражено в периодической системе в виде горизонтальных и вертикальных рядов – периодов и групп.
Период представляет собой последовательный ряд элементов, в атомах которых происходит заполнение одинакового числа энергетических уровней (электронных слоев). Номер периода указывает на число электронных слоев в атомах элементов. Периоды начинаются s-элементами, в атомах которых на новом уровне появляется первый s – электрон с новым значением главного квантового числа n (водород и щелочные металлы), а заканчиваются р – элементами, атомами благородных газов, имеющих устойчивую электронную структуру внешнего уровня ns 2 np 6 (у первого периода – s – элементом 2 He).
Различие в последовательности заполнения электронных слоев (внешних и более близких к ядру) объясняет причину различной длины периодов. 1,2,3 периоды – малые, 4,5,6,7 – большие периоды. Малые периоды содержат 2 и 8 элементов, большие периоды – 18 и 32 элемента, седьмой период остается незавершенным, хотя конструктивно он построен аналогично шестому периоду.
В соответствии с максимальным числом электронов на внешнем уровне невозбужденных атомов элементы периодической системы подразделяются на восемь групп. Группы элементов – это совокупность элементов с одинаковым количеством валентных электронов в атоме. Номер группы равен числу валентных электронов.
Положение в группах s- и p- элементов определяется общим числом электронов внешнего слоя. Например, фосфор (), имеющий на внешнем слое пять электронов, относится кV группе, аргон () – кVIII, кальций () – коII группе и т. д.
Положение в группах d – элементов обусловливается общим числом s – электронов внешнего и d – электронов предвнешнего уровня. По этому признаку первые шесть элементов каждого семейства d – элементов располагаются в одной из соответствующих групп: скандий вIII, марганец вVII, железо вVIII и т. д. Цинк , у которого предвнешний слой завершен и внешними являются- электроны, относится коII группе. В атомах d – элементов, как правило, на внешнем уровне содержится по два электрона, за исключением Cr, Cu, Nb, Mo, Ru, Rh, Ag, Pt, Au. У последних наблюдается энергетически выгодный «провал» одного электрона с внешнего уровня на d – подуровень предвнешнего уровня, что происходит при достройке этого подуровня до пяти (половинная емкость) или десяти электронов (максимальная емкость), т. е. до состояния, когда все орбитали заняты каждая одним электроном или когда они заняты каждая парой электронов. В атоме палладия (Pd) происходит «двойной провал» электронов.
По наличию на внешнем слое лишь одного электрона (за счет «провала» одного из s – электронов внешнего слоя в предвнешний d – подслой) медь (), а также сереброи золотоотносят кI группе. Кобальт и никель, родийи палладий, иридийи платинувместе сFe, Ru, и Os обычно помещают в VIII группу.
В соответствии с особенностями электронных структур семейства 4f – (лантаноиды) и 5f – (актиноиды) элементов помещают в III группу.
Группы делятся на подгруппы: главные (подгруппы А) и побочные (подгруппы В). Подгруппы включают в себя элементы с аналогичными электронными структурами (элементы - аналоги). s - и р – элементы составляют так называемую главную подгруппу, или подгруппу А, d – элементы – побочную, или подгруппу В.
Например, IV группа периодической системы состоит из следующих подгрупп:
|
Элементы главной подгруппы (А) |
Элементы побочной подгруппы (В) |
Периодическая система - упорядоченное множество химических элементов, их естественная классификация, которая является графическим (табличным) выражением периодического закона химических элементов. Структура её, во многом сходная с современной, разработана Д. И. Менделеевым на основе периодического закона в 1869–1871 гг.
Прообразом периодической системы был «Опыт системы элементов, основанной на их атомном весе и химическом сходстве», составленный Д. И. Менделеевым 1 марта 1869 г. На протяжении двух с половиной лет ученый непрерывно совершенствовал «Опыт системы», ввел представление о группах, рядах и периодах элементов. В результате структура периодической системы приобрела во многом современные очертания.
Важным для её эволюции стало понятие о месте элемента в системе, определяемом номерами группы и периода. Опираясь на это понятие, Менделеев пришел к выводу, что необходимо изменить атомные массы некоторых элементов: урана, индия, церия и его спутников. Это было первое практическое применение периодической системы. Менделеев также впервые предсказал существование и свойства нескольких неизвестных элементов. Ученый подробно описал важнейшие свойства экаалюминия (будущего галлия), экабора (скандия) и экасилиция (германия). Кроме того, он предсказал существование аналогов марганца (будущих технеция и рения), теллура (полония), иода (астата), цезия (франция), бария (радия), тантала (протактиния). Прогнозы ученого в отношении данных элементов носили общий характер, поскольку эти элементы располагались в малоизученных областях периодической системы.
Первые варианты периодической системы во многом представляли лишь эмпирическое обобщение. Ведь был неясен физический смысл периодического закона, отсутствовало объяснение причин периодического изменения свойств элементов в зависимости от возрастания атомных масс. В связи с этим оставались нерешенными многие проблемы. Есть ли границы периодической системы? Можно ли определить точное количество существующих элементов? Оставалась неясной структура шестого периода - каково точное количество редкоземельных элементов? Было неизвестно, существуют ли еще элементы между водородом и литием, какова структура первого периода. Поэтому вплоть до физического обоснования периодического закона и разработки теории периодической системы перед ней не раз возникали серьезные трудности. Неожиданным было открытие в 1894–1898 гг. пяти инертных газов, которым, казалось, не находилось места в периодической системе. Эта трудность была устранена благодаря идее включить в структуру периодической системы самостоятельную нулевую группу. Массовое открытие радиоэлементов на стыке XIX и XX вв. (к 1910 г. их число составило около 40) привело к резкому противоречию между необходимостью их размещения в периодической системе и её сложившейся структурой. Для них было только 7 вакантных мест в шестом и седьмом периодах. Эта проблема была решена в результате установления правил сдвига и открытия изотопов.
Одна из главных причин невозможности объяснить физический смысл периодического закона и структуру периодической системы состояла в том, что было неизвестно, как устроен атом (см. Атом). Важнейшей вехой на пути развития периодической системы явилось создание атомной модели Э. Резерфордом (1911). На её основе голландский ученый А. Ван ден Брук (1913) высказал предположение, что порядковый номер элемента в периодической системе численно равен заряду ядра его атома (Z). Это экспериментально подтвердил английский ученый Г. Мозли (1913). Периодический закон получил физическое обоснование: периодичность изменения свойств элементов стала рассматриваться в зависимости от Z - заряда ядра атома элемента, а не от атомной массы (см. Периодический закон химических элементов).
В результате структура периодической системы значительно упрочилась. Была определена нижняя граница системы. Это водород - элемент с минимальным Z = 1. Стало возможным точно оценить количество элементов между водородом и ураном. Были определены «пробелы» в периодической системе, соответствующие неизвестным элементам с Z = 43, 61, 72, 75, 85, 87. Однако оставались неясными вопросы о точном количестве редкоземельных элементов и, что особенно важно, не были вскрыты причины периодичности изменения свойств элементов в зависимости от Z.
Опираясь на сложившуюся структуру периодической системы и результаты изучения атомных спектров, датский ученый Н. Бор в 1918–1921 гг. развил представления о последовательности построения электронных оболочек и подоболочек в атомах. Ученый пришел к выводу, что сходные типы электронных конфигураций внешних оболочек атомов периодически повторяются. Таким образом, было показано, что периодичность изменения свойств химических элементов объясняется существованием периодичности в построении электронных оболочек и подоболочек атомов.
Периодическая система охватывает более 100 элементов. Из них все трансурановые элементы (Z = 93–110), а также элементы с Z = 43 (технеций), 61 (прометий), 85 (астат), 87 (франций) получены искусственно. За всю историю существования периодической системы было предложено очень большое количество (>500) вариантов её графического изображения, преимущественно в виде таблиц, а также в виде различных геометрических фигур (пространственных и плоскостных), аналитических кривых (спиралей и пр.) и т. д. Наибольшее распространение получили короткая, полудлинная, длинная и лестничная формы таблиц. В настоящее время предпочтение отдается короткой форме.
Фундаментальным принципом построения периодической системы является её подразделение на группы и периоды. Менделеевское понятие рядов элементов ныне не употребляется, поскольку лишено физического смысла. Группы, в свою очередь, подразделяются на главную (а) и побочную (Ь) подгруппы. В каждой подгруппе содержатся элементы - химические аналоги. Элементы a‑ и b‑подгрупп в большинстве групп также обнаруживают между собой определенное сходство, главным образом в высших степенях окисления, которые, как правило, равны номеру группы. Периодом называется совокупность элементов, которая начинается щелочным металлом и заканчивается инертным газом (особый случай - первый период). Каждый период содержит строго определенное количество элементов. Периодическая система состоит из восьми групп и семи периодов, причем седьмой период пока не завершен.
Особенность первого периода заключается в том, что он содержит всего 2 газообразных в свободном виде элемента: водород и гелий. Место водорода в системе неоднозначно. Поскольку он проявляет свойства, общие со щелочными металлами и с галогенами, то его помещают либо в 1a‑, либо в Vlla‑подгруппу, либо в обе одновременно, заключая в одной из подгрупп символ в скобки. Гелий - первый представитель VIIIa‑подгруппы. Долгое время гелий и все инертные газы выделяли в самостоятельную нулевую группу. Это положение потребовало пересмотра после синтеза химических соединений криптона, ксенона и радона. В результате инертные газы и элементы бывшей VIII группы (железо, кобальт, никель и платиновые металлы) были объединены в рамках одной группы.
Второй период содержит 8 элементов. Он начинается щелочным металлом литием, единственная степень окисления которого +1. Далее следует бериллий (металл, степень окисления +2). Бор проявляет уже слабо выраженный металлический характер и является неметаллом (степень окисления +3). Следующий за бором углерод - типичный неметалл, который проявляет степени окисления как +4, так и −4. Азот, кислород, фтор и неон - все неметаллы, причем у азота высшая степень окисления +5 соответствует номеру группы. Кислород и фтор относятся к самым активным неметаллам. Инертный газ неон завершает период.
Третий период (натрий - аргон) также содержит 8 элементов. Характер изменения их свойств во многом аналогичен тому, который наблюдался для элементов второго периода. Но здесь есть и своя специфика. Так, магний в отличие от бериллия более металличен, так же как и алюминий по сравнению с бором. Кремний, фосфор, сера, хлор, аргон - все это типичные неметаллы. И все они, кроме аргона, проявляют высшие степени окисления, равные номеру группы.
Как видим, в обоих периодах по мере увеличения Z наблюдается отчетливое ослабление металлических и усиление неметаллических свойств элементов. Д. И. Менделеев называл элементы второго и третьего периодов (по его словам, малых) типическими. Элементы малых периодов принадлежат к числу самых распространенных в природе. Углерод, азот и кислород (наряду с водородом) - органогены, т. е. основные элементы органической материи.
Все элементы первого - третьего периодов размещаются в a‑подгруппах.
Четвертый период (калий - криптон) содержит 18 элементов. По Менделееву, это первый большой период. После щелочного металла калия и щелочноземельного металла кальция следует ряд элементов, состоящий из 10 так называемых переходных металлов (скандий - цинк). Все они входят в b‑подгруппы. Большинство переходных металлов проявляют высшие степени окисления, равные номеру группы, кроме железа, кобальта и никеля. Элементы, начиная с галлия и кончая криптоном, принадлежат к а-подгруппам. Для криптона известен ряд химических соединений.
Пятый период (рубидий - ксенон) по своему построению аналогичен четвертому. В нем также содержится вставка из 10 переходных металлов (иттрий - кадмий). У элементов этого периода есть свои особенности. В триаде рутений - родий - палладий для рутения известны соединения, где он проявляет степень окисления +8. Все элементы a‑подгрупп проявляют высшие степени окисления, равные номеру группы. Особенности изменения свойств у элементов четвертого и пятого периодов по мере роста Z имеют по сравнению со вторым и третьим периодами более сложный характер.
Шестой период (цезий - радон) включает 32 элемента. В этом периоде кроме 10 переходных металлов (лантан, гафний - ртуть) содержится еще и совокупность из 14 лантаноидов - от церия до лютеция. Элементы от церия до лютеция химически очень похожи, и на этом основании их давно включают в семейство редкоземельных элементов. В короткой форме периодической системы ряд лантаноидов включают в клетку лантана и расшифровку этого ряда дают внизу таблицы (см. Лантаноиды).
В чем состоит специфика элементов шестого периода? В триаде осмий - иридий - платина для осмия известна степень окисления +8. Астат имеет достаточно выраженный металлический характер. Радон обладает наибольшей реакционной способностью из всех инертных газов. К сожалению, из‑за того, что он сильно радиоактивен, его химия мало изучена (см. Радиоактивные элементы).
Седьмой период начинается с франция. Подобно шестому, он также должен содержать 32 элемента, но из них пока известны 24. Франций и радий соответственно являются элементами Ia‑ и IIa‑подгрупп, актиний принадлежит к IIIb‑подгруппе. Далее следует семейство актиноидов, которое включает элементы от тория до лоуренсия и размещается аналогично лантаноидам. Расшифровка этого ряда элементов также дается внизу таблицы.
Теперь посмотрим, как изменяются свойства химических элементов в подгруппах периодической системы. Основная закономерность этого изменения заключается в усилении металлического характера элементов по мере роста Z. Особенно отчетливо эта закономерность проявляется в IIIa–VIIa‑подгруппах. Для металлов Ia–IIIa‑подгрупп наблюдается рост химической активности. У элементов IVa–VIIa‑подгрупп по мере увеличения Z наблюдается ослабление химической активности элементов. У элементов b‑подгрупп характер изменения химической активности более сложен.
Теория периодической системы была разработана Н. Бором и другими учеными в 20‑х гг. XX в. и основана на реальной схеме формирования электронных конфигураций атомов (см. Атом). Согласно этой теории, по мере роста Z заполнение электронных оболочек и подоболочек в атомах элементов, входящих в периоды периодической системы, происходит в следующей последовательности:
| Номера периодов | ||||||
|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 1s | 2s2p | 3s3p | 4s3d4p | 5s4d5p | 6s4f5d6p | 7s5f6d7p |
На основании теории периодической системы можно дать следующее определение периода: период есть совокупность элементов, начинающаяся элементом со значением n, равным номеру периода, и l = 0 (s‑элементы) и заканчивающаяся элементом с тем же значением n и l = 1 (p‑элементы) (см. Атом). Исключение составляет первый период, содержащий только 1s‑элементы. Из теории периодической системы следуют числа элементов в периодах: 2, 8, 8, 18, 18, 32…
В таблице символы элементов каждого типа (s‑, p‑, d‑ и f‑элементы) изображены на определенном цветовом фоне: s‑элементы - на красном, p‑элементы - на оранжевом, d‑элементы - на синем, f‑элементы - на зеленом. В каждой клетке приведены порядковые номера и атомные массы элементов, а также электронные конфигурации внешних электронных оболочек.
Из теории периодической системы следует, что к a‑подгруппам принадлежат элементы с n, равным номеру периода, и l = 0 и 1. К b‑подгруппам относятся те элементы, в атомах которых происходит достройка оболочек, ранее остававшихся незавершенными. Именно поэтому первый, второй и третий периоды не содержат элементов b‑подгрупп.
Структура периодической системы элементов тесно связана со строением атомов химических элементов. По мере роста Z периодически повторяются сходные типы конфигурации внешних электронных оболочек. А именно они определяют основные особенности химического поведения элементов. Эти особенности по‑разному проявляются для элементов a‑подгрупп (s‑ и р‑элементы), для элементов b‑подгрупп (переходные d‑элементы) и элементов f‑семейств - лантаноидов и актиноидов. Особый случай представляют элементы первого периода - водород и гелий. Для водорода характерна высокая химическая активность, потому что его единственный 1s‑электрон легко отщепляется. В то же время конфигурация гелия (1s 2) весьма устойчива, что обусловливает его химическую бездеятельность.
У элементов а-подгрупп происходит заполнение внешних электронных оболочек атомов (с n, равным номеру периода), поэтому свойства этих элементов заметно изменяются по мере роста Z. Так, во втором периоде литий (конфигурация 2s) - активный металл, легко теряющий единственный валентный электрон; бериллий (2s 2) - также металл, но менее активный вследствие того, что его внешние электроны более прочно связаны с ядром. Далее, бор (2s 2 p) имеет слабо выраженный металлический характер, а все последующие элементы второго периода, у которых происходит построение 2p‑подоболочки, являются уже неметаллами. Восьмиэлектронная конфигурация внешней электронной оболочки неона (2s 2 p 6) - инертного газа - очень прочна.
Химические свойства элементов второго периода объясняются стремлением их атомов приобрести электронную конфигурацию ближайшего инертного газа (конфигурацию гелия - для элементов от лития до углерода или конфигурацию неона - для элементов от углерода до фтора). Вот почему, например, кислород не может проявлять высшей степени окисления, равной номеру группы: ведь ему легче достичь конфигурации неона путем приобретения дополнительных электронов. Такой же характер изменения свойств проявляется у элементов третьего периода и у s‑ и p‑элементов всех последующих периодов. В то же время ослабление прочности связи внешних электронов с ядром в a‑подгруппах по мере роста Z проявляется в свойствах соответствующих элементов. Так, для s‑элементов отмечается заметный рост химической активности по мере роста Z, а для p‑элементов - нарастание металлических свойств.
В атомах переходных d‑элементов достраиваются не завершенные ранее оболочки со значением главного квантового числа n, на единицу меньшим номера периода. За отдельными исключениями, конфигурация внешних электронных оболочек атомов переходных элементов - ns 2 . Поэтому все d‑элементы являются металлами, и именно поэтому изменения свойств d‑элементов по мере роста Z не так резки, как это наблюдается у s‑ и p‑элементов. В высших степенях окисления d‑элементы проявляют определенное сходство с p‑элементами соответствующих групп периодической системы.
Особенности свойств элементов триад (VIIIb‑подгруппа) объясняются тем, что b‑подоболочки близки к завершению. Вот почему железо, кобальт, никель и платиновые металлы, как правило, не склонны давать соединения высших степеней окисления. Исключение составляют лишь рутений и осмий, дающие оксиды RuO 4 и OsO 4 . У элементов Ib‑ и IIb‑подгрупп d‑подоболочка фактически оказывается завершенной. Поэтому они проявляют степени окисления, равные номеру группы.
В атомах лантаноидов и актиноидов (все они металлы) происходит достройка ранее не завершенных электронных оболочек со значением главного квантового числа n на две единицы меньше номера периода. В атомах этих элементов конфигурация внешней электронной оболочки (ns 2) сохраняется неизменной, а заполняется третья снаружи N‑оболочка 4f‑электронами. Вот почему лантаноиды так сходны.
У актиноидов дело обстоит сложнее. В атомах элементов с Z = 90–95 электроны 6d и 5f могут принимать участие в химических взаимодействиях. Поэтому актиноиды имеют гораздо больше степеней окисления. Например, для нептуния, плутония и америция известны соединения, где эти элементы выступают в семивалентном состоянии. Только у элементов, начиная с кюрия (Z = 96), становится устойчивым трехвалентное состояние, но и здесь есть свои особенности. Таким образом, свойства актиноидов значительно отличаются от свойств лантаноидов, и оба семейства поэтому нельзя считать подобными.
Семейство актиноидов заканчивается элементом с Z = 103 (лоуренсий). Оценка химических свойств курчатовия (Z = 104) и нильсбория (Z = 105) показывает, что эти элементы должны быть аналогами соответственно гафния и тантала. Поэтому ученые полагают, что после семейства актиноидов в атомах начинается систематическое заполнение 6d‑подоболочки. Оценка химической природы элементов с Z = 106–110 экспериментально не проводилась.
Конечное число элементов, которое охватывает периодическая система, неизвестно. Проблема её верхней границы - это, пожалуй, основная загадка периодической системы. Наиболее тяжелый элемент, который удалось обнаружить в природе,- это плутоний (Z = 94). Достигнутый предел искусственного ядерного синтеза - элемент с порядковым номером 110. Остается открытым вопрос: удастся ли получить элементы с большими порядковыми номерами, какие и сколько? На него нельзя пока ответить сколь‑либо определенно.
С помощью сложнейших расчетов, выполненных на электронных вычислительных машинах, ученые попытались определить строение атомов и оценить важнейшие свойства «сверхэлементов», вплоть до огромных порядковых номеров (Z = 172 и даже Z = 184). Полученные результаты оказались весьма неожиданными. Например, в атоме элемента с Z = 121 предполагается появление 8p‑электрона; это после того, как в атомах с Z = 119 и 120 завершилось формирование 8s‑подоболочки. А ведь появление p‑электронов вслед за s‑электронами наблюдается только в атомах элементов второго и третьего периодов. Расчеты показывают также, что у элементов гипотетического восьмого периода заполнение электронных оболочек и под-оболочек атомов происходит в очень сложной и своеобразной последовательности. Поэтому оценить свойства соответствующих элементов - проблема весьма сложная. Казалось бы, восьмой период должен содержать 50 элементов (Z = 119–168), но, согласно расчетам, он должен завершаться у элемента с Z = 164, т. е. на 4 порядковых номера раньше. А «экзотический» девятый период, оказывается, должен состоять из 8 элементов. Вот его «электронная» запись: 9s 2 8p 4 9p 2 . Иными словами, он содержал бы всего 8 элементов, как второй и третий периоды.
Трудно сказать, насколько соответствовали бы истине расчеты, проделанные с помощью компьютера. Однако если бы они были подтверждены, то пришлось бы серьезно пересмотреть закономерности, лежащие в основе периодической системы элементов и её структуры.
Периодическая система сыграла и продолжает играть огромную роль в развитии различных областей естествознания. Она явилась важнейшим достижением атомно-молекулярного учения, способствовала появлению современного понятия «химический элемент» и уточнению понятий о простых веществах и соединениях.
Закономерности, вскрытые периодической системой, оказали существенное влияние на разработку теории строения атомов, открытие изотопов, появление представлений о ядерной периодичности. С периодической системой связана строго научная постановка проблемы прогнозирования в химии. Это проявилось в предсказании существования и свойств неизвестных элементов и новых особенностей химического поведения элементов уже открытых. Ныне периодическая система представляет фундамент химии, в первую очередь неорганической, существенно помогая решению задачи химического синтеза веществ с заранее заданными свойствами, разработке новых полупроводниковых материалов, подбору специфических катализаторов для различных химических процессов и т. д. И наконец, периодическая система лежит в основе преподавания химии.
Четыре способа присоединения нуклонов
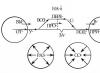
Механизмы присоединения нуклонов можно разбить на четыре типа, S, P, D и F. Эти типы присоединения отражает цветовой фон в представленном нами варианте таблицы Д.И. Менделеева.
Первый тип присоединения, это S схема, когда нуклоны присоединяются к ядру по вертикальной оси. Отображение присоединенных нуклонов этого типа, в межъядерном пространстве, ныне идентифицируется, как S электроны, хотя никаких S электронов в этой зоне нет, а есть только сферические области объемного пространственного заряда, которые обеспечивают молекулярное взаимодействие.
Второй тип присоединения - это P схема, когда нуклоны присоединяются к ядру в горизонтальной плоскости. Отображение этих нуклонов в межъядерном пространстве идентифицировано, как P электроны, хотя это тоже, всего лишь области пространственного заряда, генерируемые ядром в межъядерном пространстве.
Третий тип присоединения - это D схема, когда нуклоны присоединяются к нейтронам в горизонтальной плоскости, и наконец, четвертый тип присоединения - это F схема, когда нуклоны присоединяются к нейтронам по вертикальной оси. Каждый тип присоединения придает атому свойства, характерные для этого типа связи, поэтому в составе периодов таблицы Д.И. Менделеева давно выделены подгруппы, по типу S, P, D и F связи.
Поскольку при присоединении каждого последующего нуклона образуется изотоп или предшествующего или последующего элемента, то точное расположение нуклонов по типу S, P, D и F связи можно показать только при помощи Таблицы известных изотопов (нуклидов), вариантом которой (из Википедии) мы воспользовались.
Эту таблицу мы разбили на периоды (см. Таблицы заполнения периодов), а в каждом периоде указали, по какой схеме присоединяется каждый нуклон. Поскольку в соответствии с микроквантовой теорией каждый нуклон может присоединиться к ядру только в строго определенном месте, то количество и схемы присоединения нуклонов в каждом периоде отличаются, но во всех периодах таблицы Д.И. Менделеева законы присоединения нуклонов исполняются ЕДИНООБРАЗНО для всех нуклонов без исключения.
Как вы видите, во II и III периоде присоединение нуклонов идет только по S и P схемам, в IV и V периодах – по S, P и D схемам, а в VI и VII периодах – по S, P, D и F схемам. При этом оказалось, что законы присоединения нуклонов исполняются настолько точно, что нам не составило большого труда рассчитать состав ядра конечных элементов VII периода, которые в таблице Д.И. Менделеева имеют номера 113, 114, 115, 116 и 118.
По нашим расчетам, последний элемент VII периода, который мы назвали Rs («Россий» от «Россия»), состоит из 314 нуклонов и имеет изотопы 314, 315, 316, 317 и 318. Предшествующий ему элемент Nr («Новороссий» от «Новороссия») состоит из 313 нуклонов. Мы будем весьма благодарны всем, кто сможет подтвердить или опровергнуть наши расчеты.
Честно говоря, мы сами поражены, насколько точно работает Вселенский Конструктор, который обеспечивает присоединение каждого последующего нуклона только на свое, единственно правильное место, а если нуклон встал неправильно, то Конструктор обеспечивает распад атома, и из его запчастей собирает новый атом. В своих фильмах мы показали только главные законы работы Вселенского Конструктора, но в его работе столько нюансов, что, чтобы разобраться в них, потребуются усилия многих поколений ученых.
Но в законах работы Вселенского Конструктора человечеству разобраться необходимо, если оно заинтересовано в технологическом прогрессе, поскольку знание принципов работы Вселенского Конструктора открывает совершенно новые перспективы во всех областях человеческой деятельности – от создания уникальных конструкционных материалов до сборки живых организмов.
Заполнение второго периода таблицы химических элементов

Заполнение третьего периода таблицы химических элементов

Заполнение четвертого периода таблицы химических элементов

Заполнение пятого периода таблицы химических элементов

Заполнение шестого периода таблицы химических элементов

Заполнение седьмого периода таблицы химических элементов

Открытие Дмитрием Менделеевым периодической таблицы химических элементов в марте 1869 года стало настоящим прорывом в химии. Российскому ученому удалось систематизировать знания о химических элементах и представить их в виде таблицы, которую и сейчас обязательно изучают школьники на уроках химии. Периодическая таблица стала фундаментом для бурного развития этой сложной и интересной науки, а история ее открытия окутана легендами и мифами. Для всех увлекающихся наукой будет интересно узнать правду о том, как Менделеев открыл таблицу периодических элементов.
История таблицы Менделеева: как все начиналось
Попытки классифицировать и систематизировать известные химические элементы предпринимались задолго до Дмитрия Менделеева. Свои системы элементов предлагали такие известные ученые, как Деберейнер, Ньюлендс, Мейер и другие. Однако из-за нехватки данных о химических элементах и их правильных атомных массах предложенные системы были не совсем достоверными.
История открытия таблицы Менделеева начинается в 1869 году, когда российский ученый на заседании Русского химического общества рассказал своим коллегам о сделанном им открытии. В предложенной ученым таблице химические элементы располагались в зависимости от их свойств, обеспечивающихся величиной их молекулярной массы.
Интересной особенностью таблицы Менделеева было также наличие пустых клеток, которые в будущем были заполнены открытыми химическими элементами, предсказанными ученым (германий, галлий, скандий). После открытия периодической таблицы в нее много раз вносились добавления и поправки. Совместно с шотландским химиком Уильямом Рамзаем Менделеев добавил в таблицу группу инертных газов (нулевую группу).
В дальнейшем история периодической таблицы Менделеева была напрямую связана с открытиями в другой науке – физике. Работа над таблицей периодических элементов продолжается до сих пор, и современные ученые добавляют новые химические элементы по мере их открытия. Значение периодической системы Дмитрия Менделеева сложно переоценить, так как благодаря ей:
- Систематизировались знания о свойствах уже открытых химических элементов;
- Появилась возможность прогнозирования открытия новых химических элементов;
- Начали развиваться такие разделы физики, как физика атома и физика ядра;
Существует множество вариантов изображения химических элементов согласно периодическому закону, однако наиболее известный и распространенный вариант – это привычная для каждого таблица Менделеева.
Мифы и факты о создании периодической таблицы
Самым распространенным заблуждением в истории открытия таблицы Менделеева является то, что ученый увидел ее во сне. На самом деле сам Дмитрий Менделеев опроверг этот миф и заявил, что размышлял над периодическим законом на протяжении многих лет. Чтобы систематизировать химические элементы он выписывал каждый из них на отдельную карточку и многократно комбинировал их между собой, расставляя в ряды в зависимости от их схожих свойств.
Миф о «вещем» сне ученого можно объяснить тем, что Менделеев работал над систематизацией химических элементов сутками напролет, прерываясь на непродолжительный сон. Однако только упорный труд и природный талант ученого дал долгожданный результат и обеспечил Дмитрию Менделееву всемирную известность.
Многих учащихся в школе, а иногда и в университете, заставляютзаучивать или хотя бы примерно ориентироваться в таблице Менделеева. Для этого человек должен не только иметь хорошую память, но и логически мыслить, связывая элементы в отдельные группы и классы. Изучение таблицы легче всего дается тем людям, которые постоянно поддерживают мозг в тонусе, проходя тренинги на BrainApps.
См. также: Список химических элементов по атомным номерам и Алфавитный список химических элементов Содержание 1 Символы, используемые в данный момент … Википедия
См. также: Список химических элементов по символам и Алфавитный список химических элементов Это список химических элементов, упорядоченный в порядке возрастания атомных номеров. В таблице приводятся название элемента, символ, группа и период в… … Википедия
- (ИСО 4217) Коды для представления валют и фондов Codes for the representation of currencies and funds (англ.) Codes pour la représentation des monnaies et types de fonds (фр.) … Википедия
Простейшая форма материи, которая может быть идентифицирована химическими методами. Это составные части простых и сложных веществ, представляющие собой совокупность атомов с одинаковым зарядом ядра. Заряд ядра атома определяется числом протонов в … Энциклопедия Кольера
Содержание 1 Эпоха палеолита 2 10 е тысячелетие до н. э. 3 9 е тысячелетие до н. э … Википедия
Содержание 1 Эпоха палеолита 2 10 е тысячелетие до н. э. 3 9 е тысячелетие до н. э … Википедия
У этого термина существуют и другие значения, см. Русские (значения). Русские … Википедия
Терминология 1: : dw Номер дня недели. «1» соответствует понедельнику Определения термина из разных документов: dw DUT Разность между московским и всемирным координированным временем, выраженная целым количеством часов Определения термина из… … Словарь-справочник терминов нормативно-технической документации