Sulful natural pur este un solid cristalin galben. În natură, sulful apare sub formă nativă, formând depozite mari. Materialul de colectare este cristale de sulf bine formate și viu colorate, cu un diamant și strălucire mată, de 1,5-15 cm sau mai mult, precum și pensule și drusele de astfel de cristale.
Din cele mai vechi timpuri, sulful a fost utilizat pe scară largă în experimentele alchimiștilor și în medicină. Când este ars, emite un miros caracteristic puternic. Mirosul și culoarea sa i-au determinat pe oameni să folosească sulful în magie timp de secole. A fost adesea ars pentru a alunga „demoni” și „diavoli”. Acest lucru s-a datorat ideii că forțele pozitive vor fi atrase de arome plăcute, în timp ce forțele negative ar urî mirosurile neplăcute și ar fugi de ele. Mai târziu, sulful a fost ars pentru a proteja animalele și pentru a opri „vrăjirea” sau înrobirea magică.
Sulful este o componentă constantă a plantelor; este conținut în ele sub formă de diferiți compuși anorganici și organici. Sulful anorganic se găsește sub formă de săruri de acid sulfuric. Sunt cunoscute bacteriile care o concentrează. Unele dintre microorganisme formează compuși specifici de sulf ca deșeuri; de exemplu, ciupercile din genul Penicillinum sintetizează penicilina antibiotică care conține sulf.
Sulful, ca și azotul, face parte din proteine, datorită cărora metabolismul proteic este atât azotat, cât și sulfuric. În țesuturi, sulful se găsește sub formă de compuși organici complecși - sulfați, fie în combinație cu carbohidrați, fie sub formă de sulfatide în combinație cu fosfatide în așa-numitele lipoide care alcătuiesc medulara.
Sulful se găsește în insulină, iar unii cercetători atribuie efectele hipoglicemiante ale insulinei sulfului pe care îl conține.
Sulful se găsește în vitamina B-tiamină anti-nevralgică, care diferențiază această vitamină de altele. În proteine, sulful este conținut în aminoacizi: cisteină, cistina, care sunt implicați în reacțiile redox ale organismului. Cisteina face parte din glutation, o substanță proteică bogată în globule roșii, ficat, glandele suprarenale și în special țesut embrionar, în care procesele oxidative au loc foarte intens.
Participând la procesele redox, sulful joacă același rol în respirația tisulară ca hemoglobina și oxihemoglobina în schimbul de gaze în plămâni.

Sulful elementar nu are un efect toxic pronunțat, dar toți compușii săi sunt toxici. Luate pe cale orală, 3 - 5 g de sulf elementar acționează ca un laxativ datorită formării de hidrogen sulfurat în intestine, stimulând peristaltismul. Dar cu aportul zilnic de doze mici de sulf de la 1,0-2,5-10 mg timp de 1-2 săptămâni apar dureri de cap, amețeli, oboseală, transpirații, creșterea ritmului cardiac, constipație, dureri abdominale, modificări ale metabolismului etc.d.
Sulful și compușii săi anorganici au fost folosiți în medicină încă din cele mai vechi timpuri pentru boli de piele, boli ale articulațiilor, intoxicații cu metale grele și ca laxativ.
Fumigarea cu sulf oprește curgerea nasului. Se aplică pe urechea zdrobită cu oțet și miere.
Proprietățile curative ale sulfului sunt utilizate pe scară largă în balneologie. Efectul apelor sulfuroase se datorează hidrogenului sulfurat pe care îl conțin. Absorbit prin piele și plămâni, hidrogenul sulfurat provoacă înroșirea pielii din expansiunea celor mai mici vase de sânge din piele, o încetinire a pulsului cu 10-15 bătăi și o scădere a presiunii sistolice și diastolice cu 5-10 mm. . Tratamentul cu ape sulfuroase se foloseste pentru diferite tipuri de afectiuni: artropatii cronice de etiologie reumatica si guta, afectiuni ale muschiului inimii precum cardioscleroza, osteomielita cu fistule recurente, boli cronice ale femeilor, boli cronice ale pielii, intoxicatii cu mercur si plumb la locul de munca.
Contraindicațiile tratamentului cu ape sulfuroase sunt bolile acute și subacute ale inimii, articulațiilor, organelor feminine, hipertensiunea arterială cu simptome de nefroscleroză, anchiloza osoasă, furunculoza și toate bolile piodermice.
Următorii compuși anorganici de sulf sunt utilizați în prezent:
Natrium hyposulfurosum, tiosulfatul de sodiu (hiposulfat), este utilizat (după metoda Demyanovich) ca remediu extern pentru tratamentul scabiei și a unor boli fungice ale pielii.
Sulphur depuratum, sulf purificat (Flos sulfurise, sulphur color), este utilizat ca laxativ pentru constipație (0,5-1,0 g per doză) și pentru tratamentul enterobiazei (oxiuri). Inclus în pulbere complexă de lemn dulce (Pulvis Glycyrrhisae compositae). În 1926, psihiatrul danez K. Schroeder a propus tratamentul cu injecții intramusculare cu 1% sulf purificat pentru boli precum neurolues, tabes, paralizie și schizofrenie.

Utilizat extern în unguentul Wilkinson și sulful simplu.
Calcium sulfuricum, sulfat de calciu, eliberează apă la încălzire și se transformă în ipsos ars, folosit în chirurgie pentru pansamente.
În ultimii 20 de ani, medicina a început să folosească pe scară largă preparatele organice cu sulf. În 1935, omul de știință german Domagk a propus medicamentul Prontosil care conține sulfogrup 802. Acest remediu s-a dovedit a fi eficient în lupta împotriva microbilor. Industria farmaceutică a creat un număr mare de medicamente sulfonamide. Cea mai simplă structură chimică este streptocidul alb. Toate celelalte medicamente sulfonamide sunt derivați de streptocid alb. Acestea sunt sulfadină, sulfazol, norsulfazol, sulfazin, sulfadimezin, urosulfan, disulfan, sulgin, ftalazol, sulfozin etc. Toate aceste medicamente sunt agenți extrem de activi în lupta împotriva bolilor severe cauzate de coci și bacili pe care au
produc un efect bacteriostatic, dar conținutul din ele, pe lângă grupele benzen, amido și sulfo poate duce la reacții adverse.
În homeopatie se utilizează atât sulful elementar, cât și diferiții săi compuși, dar în fruntea tuturor compușilor cu sulf se află sulful elementar - Sulful. Sulful a fost testat în mod repetat de către Hahnemann, în care a văzut principalul remediu împotriva suferinței principale a umanității - „psora”. Cu acest termen, Hahnemann a unit toate bolile de piele exprimate prin mâncărime, erupții cutanate, negi și alte modificări ale pielii. Experiența a arătat că sulful este un remediu de care rareori se poate renunța în tratamentul bolilor acute severe și niciodată în tratamentul celor cronice.
Sulful este cel mai puternic activator al diferitelor tulburări ale metabolismului sulfului (proteinelor) și, într-adevăr, este un medicament de o importanță capitală. Selectivitatea sulfului pentru piele a făcut din acesta de multă vreme principalul remediu pentru bolile de piele. Sulful este folosit și pentru boli ale sistemului nervos central, ceea ce este ușor de explicat: pielea și sistemul nervos sunt conectate printr-o origine comună.
Dar utilizarea sulfului, chiar și în doze homeopate, necesită o mare prudență, mai ales la persoanele cu metabolismul sulf afectat sau care suferă de boli alergice - astm, eczeme, edem Quincke. În astfel de cazuri, sulful poate provoca o agravare severă.
Card de diagnostic.
Cristale de sulf din Cozzodisi (Agrigento)
S
Sistem rombic sau monoclinic
Duritatea 2
Greutate specifică 2-2.1
Decolteu imperfect
Fractură concoidală
Culoare galben, maro
Culoarea pudrei este albă
Luciu de la gudron la gras

Sulful nativ - S. Luciul este gras până la diamant, mineralul este transparent până la translucid. Culori: galben, la intemperii devine gri sau maro spre negru. Linia este galben deschis, fractura este concoidală, neuniformă. Foarte fragil. Decolteul este imperfect. Sulful se formează ca produs al sublimelor vulcanice și se găsește și în depozitele sedimentare biogene.
Cristalele (sistemul rombic) sunt piramidale, în formă de butoi. Articulațiile sunt comune. Agregatele sunt solide, cu granulație grosieră, dense, uneori pământoase (există descărcări în formă de ciorchini și în formă de rinichi), depozite pulverulente. Folosit pentru prepararea acidului sulfuric, în industria cauciucului și pentru combaterea dăunătorilor din agricultură. Locuri de distribuție: insula Sicilia (Italia), Spania. Polonia, CSI, Japonia, buc. Louisiana (SUA), Mexic.
Sulful este un exemplu de polimorfism. În faza stabilă (până la 95 o C) sistemul ortorombic, în intervalul de până la 119 o C, devine monoclinic. Se topește pe măsură ce temperatura crește. În natură, datorită acestui fapt, se găsește în principal sub formă rombică. Sulful formează cristale bipiramidale și agregate granulare. Culoarea caracteristică a acestui mineral este galbenul lămâie, care se poate schimba în aproape negru din cauza contaminării cu bitum.

Sulf (galben). Insula Guam, Oceanul Pacific, SUA. 10 cm Foto: A.A. Evseev.
 Sulful (în engleză Sulphur, franceză Sufre, germană Schwefel) în starea sa natală, precum și sub formă de compuși ai sulfului, este cunoscut încă din cele mai vechi timpuri. Omul s-a familiarizat probabil cu mirosul de sulf ars, efectul sufocant al dioxidului de sulf și mirosul dezgustător al hidrogenului sulfurat încă din timpuri preistorice. Aproximativ jumătate din producția mondială de sulf provine din rezervele naturale.
Sulful (în engleză Sulphur, franceză Sufre, germană Schwefel) în starea sa natală, precum și sub formă de compuși ai sulfului, este cunoscut încă din cele mai vechi timpuri. Omul s-a familiarizat probabil cu mirosul de sulf ars, efectul sufocant al dioxidului de sulf și mirosul dezgustător al hidrogenului sulfurat încă din timpuri preistorice. Aproximativ jumătate din producția mondială de sulf provine din rezervele naturale.
Semne diagnostice.
Conductor de căldură fragil, slab; Uneori, o atingere a mâinii este suficientă pentru a face crăparea cristalului. Încărcat cu electricitate atunci când este frecat. Se topește la temperatură scăzută și arde în aer, eliberând gaz toxic de anhidridă sulfurică.
Origine.
Sulful este un mineral caracteristic depozitelor sedimentare precum evaporitele și sublimarea vulcanică directă („uscă”), precum și un element al izvoarelor vulcanice (termale) sulfuroase (ape otrăvitoare și vapori fierbinți de sulf și acid). Se crede că se formează în timpul descompunerii sulfaților, în primul rând gipsul (cu care se găsește cel mai adesea împreună), sub influența bacteriilor, în primul rând „tiobacteriile”. Faza monoclinica se formeaza in timpul sublimarii vaporilor de acid sulfuros in mediu vulcanic (in solfatari). Fotografia prezintă agregate de cristale de sulf, numite în mod obișnuit „flori de sulf”.
Depozite și cereri.
Depozite mari de sulf au fost găsite în Texas și Louisiana pe acoperișul domurilor de sare (depozite de evaporiți) acoperite de straturi argiloase. Sulful din aceste depozite practic nu are impurități; este extras prin forarea puțurilor în care se injectează apă clocotită. Acesta topește sulful, care este apoi pompat la suprafață (metoda Flash).
Sulful este, de asemenea, obișnuit în Italia, de-a lungul aflorințelor straturilor purtătoare de sulf de gips care conturează Apeninii, în special în Romagna, Marche, Calabria și Sicilia. Sulful de acolo este interstratificat cu roci argiloase, astfel încât extracția lui (care acum a încetat) necesită o metodă destul de complexă. În minele de sulf din Sicilia se foloseau metoda extrudarii. Sulful extras din mină a fost topit și turnat în recipiente mari.


Alte zăcăminte sunt cunoscute în Japonia și Indonezia. În Italia, cristale foarte frumoase de sulf rombic sunt cunoscute din Romagna, Marche (Perticara) și Sicilia, unde sunt asociate cu celestină și aragonită. Sulful monoclinic a fost stabilit în Campi Flegeri și pe insula Vulcano. Sulful este folosit în industria chimică și pentru producerea îngrășămintelor minerale.

Sulf (cristal). Sicilia, Italia. 5x2,5 cm Foto: A.A. Evseev.

O perie de cristale de sulf (60x40 cm) din insula Sicilia (Italia). Foto: V.I. Dvoryadkin.

Sulf. Druză de cristale bipiramidale pe un cristal de gips incolor
iar în interiorul ei. Sicilia, Italia. Foto: A.A. Evseev.
Sulful este un „mineral al frumuseții” (o glumă în „zonele” sovietice, 1939-1969 din secolul XX, unde prizonierii erau supuși la sulf, printre altele). Conținutul de sulf din corpul unui adult este de aproximativ 0,16% (110 g la 70 kg greutate corporală). Sulful se găsește în toate țesuturile corpului, o mare parte din el se află în mușchi, schelet, ficat, țesut nervos, sânge - metabolism activ. Straturile de suprafață ale pielii sunt bogate în sulf galben, unde sulful face parte din cheratina și melanina. Acestea sunt sulfuri. Sulful intră în organism cu produsele alimentare, ca parte a compușilor anorganici și organici. Majoritatea sulfului intră în organism ca parte a aminoacizilor.
Principalele manifestări ale excesului de sulf: mâncărime, erupții cutanate, furunculoză, roșeață și umflare a conjunctivei; apariția unor mici defecte punctiforme pe cornee; durere în sprâncene și globi oculari, senzație de nisip în ochi; fotofobie, lacrimare, slăbiciune generală, dureri de cap, amețeli, greață, catar al tractului respirator superior, bronșită; pierderea auzului, tulburări digestive, diaree, scădere în greutate; anemie, tulburări psihice, scăderea inteligenței. Sulf - vulcani și izvoare sulfuroase, evaporarea sulfului (99,3%). Acumulare - produse. O sursă de aport în exces de sulf sunt compușii care conțin sulf (sulfiții), iar consumul tot mai mare de sulfiți este responsabil pentru creșterea incidenței astmului bronșic.
Semne ale deficienței de sulf: constipație, alergii, slăbiciune și căderea părului, unghii casante, hipertensiune arterială, dureri articulare, tahicardie, glicemie crescută și niveluri ridicate de trigliceride în sânge. Ficat gras, hemoragii la rinichi, tulburări ale metabolismului proteinelor și carbohidraților, supraexcitarea sistemului nervos, iritabilitate. Sulful este mineralul care face din usturoi „regele plantelor”.
Atomii de sulf fac parte integrantă din moleculele de aminoacizi esențiali (cistina, cisteină, metionină), hormoni (insulina, calcitonină), vitamine (biotină, tiamină), glutation, taurină și alți compuși importanți pentru organism. În compoziția lor, sulful participă la reacții redox, la procesele de respirație a țesuturilor, la producerea de energie, la transmiterea informațiilor genetice și îndeplinește multe alte funcții importante. Sulful este o componentă a proteinei structurale de colagen. Sulfatul de condroitină este prezent în piele, cartilaje, unghii, ligamente și valve miocardice. Metaboliții care conțin sulf sunt hemoglobina, heparina, citocromii, fibrinogenul și sulfolipidele.
Sulful este excretat în urină sub formă de sulf neutru și sulfați anorganici, o parte mai mică din sulf este excretat prin piele și plămâni și este excretat în principal în urină sub formă de SO42–. Acidul sulfuric endogen, format în organism, participă la neutralizarea compușilor toxici (fenol, indol etc.) produși de microflora intestinală și, de asemenea, leagă substanțe străine organismului, inclusiv medicamentele și metaboliții acestora. În acest caz, se formează compuși inofensivi - conjugați, care sunt apoi excretați din organism. Metabolismul sulfului este controlat de acei factori care au un efect reglator asupra metabolismului proteic (hormoni ai glandei pituitare, glandei tiroide, suprarenale, gonade).
ADR 2.1
Gaze inflamabile
Risc de incendiu. Risc de explozie. Poate fi sub presiune. Risc de sufocare. Poate provoca arsuri și/sau degerături. Containerele pot exploda atunci când sunt încălzite (extrem de periculoase - practic nu ard)
ADR 2.2
Cilindru de gaz Gaze neinflamabile, netoxice.
Risc de sufocare. Poate fi sub presiune. Ele pot provoca degeraturi (asemanatoare cu o arsura - paloare, vezicule, gangrena de gaze negre - scartaie). Containerele pot exploda atunci când sunt încălzite (extrem de periculoase - explozie de la o scânteie, flacără, chibrit, practic nu ard)
Folosiți capacul. Evitați suprafețele joase (găuri, zone joase, șanțuri)
Diamant verde, număr ADR, butelie de gaz alb sau negru (butelie, tip termos)
ADR 2.3
Gaze toxice. Craniu și oase încrucișate
Pericol de otrăvire. Poate fi sub presiune. Poate provoca arsuri și/sau degerături. Containerele pot exploda atunci când sunt încălzite (extrem de periculoase - răspândirea instantanee a gazelor în zona înconjurătoare)
Folosiți o mască atunci când părăsiți vehiculul în caz de urgență. Folosiți capacul. Evitați suprafețele joase (găuri, zone joase, șanțuri)
Diamant alb, număr ADR, craniu negru și oase încrucișate
ADR 3
Lichide inflamabile
Risc de incendiu. Risc de explozie. Containerele pot exploda atunci când sunt încălzite (extrem de periculoase - se arde ușor)
Folosiți capacul. Evitați suprafețele joase (găuri, zone joase, șanțuri)
Diamant roșu, număr ADR, flacără neagră sau albă
ADR 4.1
Solide inflamabile, substanțe autoreactive și explozivi solizi desensibilizați
Risc de incendiu. Substanțele inflamabile sau combustibile pot fi aprinse de scântei sau flăcări. Poate conține substanțe autoreactive care sunt capabile de descompunere exotermă la încălzire, contact cu alte substanțe (cum ar fi acizi, compuși ai metalelor grele sau amine), frecare sau șoc.
Acest lucru poate duce la eliberarea de gaze sau vapori dăunători sau inflamabili sau arderea spontană. Containerele pot exploda la încălzire (sunt extrem de periculoase - practic nu ard).
Risc de explozie a explozivilor desensibilizați în urma pierderii desensibilizatorului
Șapte dungi roșii verticale pe fundal alb, egale ca mărime, număr ADR, flacără neagră
ADR 8
Substanțe corozive (caustice).
Risc de arsuri din cauza coroziunii pielii. Pot reacționa violent între ele (componente), cu apa și alte substanțe. Materialul vărsat/împrăștiat poate elibera vapori corozivi.
Periculoase pentru mediul acvatic sau pentru sistemul de canalizare
Jumătatea superioară albă a rombului, negru - inferioară, de dimensiuni egale, număr ADR, eprubete, mâini
| Numele încărcăturii deosebit de periculoase în timpul transportului | Număr ONU | Clasă ADR |
| Anhidrida sulfurica, stabilizata TRIOXID DE SULF, STABILIZAT | 1829 | 8 |
| Anhidrida de sulf DIOXID DE SULF | 1079 | 2 |
| Disulfură de carbon DISULFURĂ DE CARBON | 1131 | 3 |
| gaz HEXAFLUORURĂ DE SULF | 1080 | 2 |
| ACID SULFURIC UTILIZAT | 1832 | 8 |
| ACID SULFURIC, FUME | 1831 | 8 |
| ACID SULFURIC, care nu conține mai mult de 51% acid, sau ACID DE BATERIE | 2796 | 8 |
| ACID SULFURIC REGENERAT DIN gudron acid | 1906 | 8 |
| ACID SULFURIC, care conține mai mult de 51% acid | 1830 | 8 |
| ACID SULFURIC | 1833 | 8 |
| SULF | 1350 | 4.1 |
| SULFUL ESTE TOPIT | 2448 | 4.1 |
| Clorura de sulf CLORURA DE SULF | 1828 | 8 |
| Hexafluorura de sulf HEXAFLUORURA DE SULF | 1080 | 2 |
| Diclorura de sulf | 1828 | 8 |
| DIOXID DE SULF | 1079 | 2 |
| TETRAFLUORURĂ DE SULF | 2418 | 2 |
| TROXID DE SULF STABILIZAT | 1829 | 8 |
| CLORURĂ DE SULF | 1828 | 8 |
| Sulfat de hidrogen | 1053 | 2 |
| DISULFUR DE CARBON | 1131 | 3 |
| Chibrituri sigure in cutii, carti, cartoane | 1944 | 4.1 |
| CHIBRIȚE DE PARAFINĂ „VESTA” | 1945 | 4.1 |
| Chibrituri cu parafină CHOCURI PARAFINĂ „VESTA” | 1945 | 4.1 |
| MECIURI DE MINE | 2254 | 4.1 |
Piatra, minerale, minerale, pietre, cristal, rasa, pietre pretioase, pietre naturale, roci, piatra pretioasa, roca, piatra salbatica, pietre si minerale, nume de pietre, piatra naturala, piatra naturala, pietre minerale, piatra semipretioasa, minerale acestea sunt catalog de pietre, mineralogie, semnificația pietrelor, ce sunt mineralele, proprietățile pietrelor, denumiri ale pietrelor și mineralelor, nume și fotografii ale pietrelor naturale, pietre naturale, pietre minerale, pietre naturale, fotografii și nume de pietre, nume minerale, fotografii cu pietre sălbatice, roci și minerale, minerale și pietre, compoziția chimică a mineralelor, din ce este făcută piatra, cele mai uimitoare pietre și minerale, listă de minerale, catalog de minerale, pietre și proprietățile lor, minerale prețioase, piatră naturală , tipuri de minerale, tipuri de minerale, cristal de piatră, proprietăți ale pietrei, pietre de geologie, minerale principale, minerale și clasificarea lor, cele mai frumoase minerale, definiția mineralelor, originea pietrelor, minerale cristaline, pietre obișnuite, clasificarea mineralelor, descrierea pietrelor, cum arată pietrele prețioase în natură, ce este o piatră, tipuri de piatră naturală, minerale valoroase, știința mineralelor, clasificarea chimică a mineralelor, proprietățile magnetice ale mineralelor, lumea mineralelor, roca minerală, ce sunt rocile și mineralele, tipuri de pietre, compoziția pietrei, descrierea mineralelor, pietre în natură, pietre utile, identificarea pietrelor, densitatea mineralelor, duritatea rocilor, imagini ale pietrelor și denumirile lor, clasificarea mineralelor, geologie, roci și minerale, nume pietre semiprețioase și fotografii, caracteristici ale mineralelor, structura pietrei, minerale în natură.
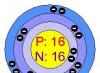
Sulful este un element al tabelului periodic al lui D.I. Mendeleev, numărul său atomic este șaisprezece. Are proprietăți nemetalice. Este desemnat prin litera latină S. Numele probabil are o rădăcină indo-europeană - „a arde”.
Perspectiva istorica
Nu este clar când a fost descoperit sulful și a început exploatarea lui. Ceea ce se știe este că oamenii antici știau despre asta cu mult înaintea erei noastre. Primii preoți îl foloseau în ritualurile lor de cult și îl includeau în amestecurile de fumigație. Sulful mineral era considerat un produs produs de zei, care trăiau în principal în lumea interlopă.
Multă vreme, după cum arată documentele istorice, a fost folosit ca componentă a amestecurilor inflamabile care au fost folosite în scopuri militare. Homer nu a ignorat nici sulful mineral. Într-una dintre lucrările sale, el a descris „vaporii” care au avut un efect dăunător asupra oamenilor atunci când au fost arși.
Istoricii sugerează că sulful a fost un element din așa-numitul „foc grecesc”, care a provocat teamă în inamici.
În secolul al VIII-lea în China, a început să fie folosit pentru a prepara amestecuri pirotehnice, inclusiv substanțe inflamabile asemănătoare prafului de pușcă.
În Evul Mediu, a fost unul dintre cele trei elemente principale ale alchimiștilor. Ei au folosit în mod activ sulful nativ mineral în cercetările lor. Acest lucru a condus adesea la faptul că experimentele cu ea au fost echivalate cu vrăjitorie, iar aceasta, la rândul său, a condus la persecuția de către Inchiziție a chimiștilor antici și a adepților lor. Din acele vremuri, din Evul Mediu și Renaștere, mirosul de sulf ars și gazele lor au început să fie asociate cu actele spiritelor rele și cu manifestările diavolești.
Proprietăți
Sulful mineral nativ are o rețea moleculară pe care alte elemente similare nu o au. Acest lucru duce la faptul că are duritate scăzută, lipsește clivaj și este un material destul de fragil. Greutatea specifică a sulfului este de 2,7 grame pe centimetru cub. Mineralul are o conductivitate electrică slabă, o conductivitate termică slabă și un punct de topire scăzut. Se aprinde liber atunci când este expus la o flacără deschisă, inclusiv un chibrit, culoarea flăcării este albastră. Se aprinde bine la temperaturi de aproximativ 248 de grade Celsius. Când este ars, emite dioxid de sulf, care are un miros înțepător și sufocant.

Descrierile mineralului sulf sunt variate. Are nuante de galben deschis, pai, miere, verzui. Sulful, care are în structură substanțe organice, are o culoare maro, gri sau negru. În fotografie, sulful mineral în forma sa solidă, pură, cristalină atrage întotdeauna privirea și este ușor de recunoscut.
Sulful vulcanic este galben strălucitor, verzui, portocaliu. În natură îl puteți găsi sub formă de diverse mase, dense, pământoase, pudrate. Cristalele cristaline de sulf crescute excesiv se găsesc și în natură, dar destul de rar.
Sulf în natură
Sulful natural se găsește rar în stare pură. Dar în scoarța terestră rezervele sale sunt foarte semnificative. Acestea sunt în principal minereuri în care straturile de sulf sunt prezente în cantități mari.

Până acum, știința nu a determinat cauza apariției depozitelor de sulf. Unele versiuni se exclud reciproc. Având în vedere că sulful prezintă activitate chimică ridicată, se presupune că în timpul formării suprafeței scoarței terestre a fost legat și eliberat în mod repetat. Cum au avut loc aceste reacții nu a fost stabilit cu siguranță.
Potrivit unei versiuni, se presupune că sulful este o consecință a leșierii sulfaților, care au devenit produse reziduale ale bacteriilor individuale. Aceștia din urmă folosesc compuși minerali ca hrană.
Cercetătorii au în vedere diferite versiuni ale proceselor de înlocuire a sulfului în scoarța terestră, care duc la eliberarea și acumularea acestuia. Dar nu este încă posibil să înțelegem clar natura apariției sale.
Proprietățile fizice și chimice ale sulfului
Prima cercetare științifică a fost efectuată abia în secolul al XVIII-lea. Un studiu amănunțit al proprietăților mineralului sulf a fost efectuat de omul de știință francez Antoine Lavoisier. Astfel, el a stabilit că se cristalizează din topituri, luând inițial forme de ace. Cu toate acestea, acest formular nu este permanent. Pe măsură ce temperatura scade, sulful se recristalizează, formând formațiuni translucide voluminoase de o nuanță galben-lămâie sau aurie.
Zăcăminte, minerit de sulf
Principala sursă de extracție a mineralului sulf sunt depozitele. Conform calculelor cercetătorilor geologici, rezultă că rezervele sale mondiale se ridică la aproximativ 1,4 miliarde de tone.

Oamenii antici, precum și minerii din Evul Mediu, extrageau sulf îngropând în adâncuri un recipient mare de lut. Pe ea a fost pus încă una, care avea o gaură în fund. Recipientul superior a fost umplut cu rocă care conținea sulf. Această structură a fost încălzită. Sulful a început să se topească și să curgă în vasul inferior.

În prezent, mineritul are loc prin exploatare deschisă, precum și prin utilizarea metodelor de topire din subteran.
Există zăcăminte mari de sulf pe teritoriul Eurasiei în Turkmenistan, regiunea Volga și în alte locuri. Pe malul stâng al râului Volga, care se întind de la Samara până la Kazan, au fost descoperite zăcăminte semnificative în Rusia.
La dezvoltarea mineralelor sulfuroase, se acordă o atenție deosebită siguranței. Acest lucru se datorează faptului că minereul este întotdeauna însoțit de o acumulare de hidrogen sulfurat, care este foarte dăunătoare pentru respirație. Mineralul în sine are capacitatea de a aprinde și de a forma compuși explozivi.
Cea mai comună metodă de exploatare este cea deschisă. În acest caz, partea superioară a rocilor este îndepărtată cu ajutorul echipamentelor miniere. Operațiunile de sablare zdrobesc partea de minereu. Apoi fracțiile sunt trimise întreprinderii pentru procesul de îmbogățire, iar apoi la fabricile de topire pentru a obține sulf pur.
Dacă mineralul se află adânc și volumele sale sunt semnificative, pentru extracție se folosește metoda Frasch.
La sfârșitul anului 1890, inginerul Frasch a propus topirea sulfului în subteran și, după ce l-a transformat în stare lichidă, pomparea lui. Acest proces este comparabil cu producția de petrol. Ținând cont de ideea destul de scăzută a inginerului, a fost testat cu succes și extracția industrială a acestui mineral a început în acest fel.

În a doua jumătate a secolului al XX-lea, metoda de extracție prin utilizarea curenților de înaltă frecvență a început să fie utilizată în mod activ. Impactul lor duce și la topirea sulfului. Injectarea ulterioară de aer cald comprimat face posibilă accelerarea ridicării acestuia în stare lichidă la suprafață.
Sulful se găsește în cantități mari în gazele naturale. Metoda Klaus este potrivită pentru extragerea acesteia. Se folosesc gropi speciale de sulf în care se efectuează degazarea. Rezultatul este un produs solid modificat cu un conținut ridicat de sulf.
Aplicație
Aproximativ jumătate din tot sulful extras este folosit pentru a produce acid sulfuric. Acest mineral este necesar și pentru producția de cauciuc, medicamente și ca fungicide în agricultură. Mineralul și-a găsit, de asemenea, aplicație ca element structural în popularul asfalt cu sulf și înlocuitor de ciment Portland - betonul cu sulf. Ele sunt utilizate în mod activ la fabricarea diferitelor compoziții pirotehnice și la producerea chibriturilor.
Rolul biologic
Sulful este un element biogen important. Face parte dintr-un număr semnificativ de aminoacizi. O componentă în formarea structurilor proteice. În fotosinteza bacteriană, mineralul participă la reacțiile redox ale organismului și este o sursă de energie. În corpul uman, există aproximativ două grame de sulf pe kilogram de greutate.
Sulful în forma sa pură nu este o substanță toxică, spre deosebire de gazele volatile, care includ anhidridă, hidrogen sulfurat și așa mai departe.
Proprietățile focului
Sulful este un mineral periculos de incendiu. Fracțiunile sale fin măcinate sunt capabile de ardere spontană în prezența umidității, în prezența contactului cu agenți oxidanți, precum și la crearea amestecurilor cu cărbune, grăsimi și uleiuri. Sulful este stins cu apă pulverizată și spumă mecanică de aer.
Descrierea și proprietățile sulfului
Sulf este o substanță care se află în grupa 16, sub a treia perioadă și are un număr atomic de 16. Poate fi găsită atât sub formă nativă, cât și legată. Sulful este desemnat prin litera S. Cunoscut formula sulfului– (Ne)3s 2 3p 4 . Sulful ca element este inclus în multe proteine.
Fotografia prezintă cristale de sulf
Dacă vorbesc despre structura atomică a elementului sulf, apoi pe orbita sa exterioară există electroni al căror număr de valență ajunge la șase.
Aceasta explică proprietatea elementului de a fi maxim hexavalent în majoritatea combinațiilor. Există patru izotopi în structura unui element chimic natural și aceștia sunt 32S, 33S, 34S și 36S. Vorbind despre învelișul exterior al electronilor, atomul are o schemă 3s2 3p4. Raza atomului este de 0,104 nanometri.
Proprietățile sulfului sunt împărțite în primul rând în tipuri fizice. Aceasta include faptul că elementul are o compoziție cristalină solidă. Două modificări alotropice sunt starea principală în care acest element de sulf este stabil.
Prima modificare este rombică, de culoare galben-lămâie. Stabilitatea sa este mai mică de 95,6 °C. Al doilea este monoclinic, având o culoare galben miere. Rezistența sa variază între 95,6 °C și 119,3 °C.

Fotografia arată sulful mineral
În timpul topirii, elementul chimic devine un lichid în mișcare de culoare galbenă. Devine maro, atingând temperaturi de peste 160 °C. Și la 190 °C culoarea sulfului se transformă în maro închis. După atingerea temperaturii de 190 °C, se observă o scădere a vâscozității substanței, care devine totuși lichidă după încălzirea la 300 °C.
Alte proprietăți ale sulfului:
Practic nu conduce căldura sau electricitatea.
Nu se dizolvă atunci când este scufundat în apă.
Este solubil în amoniac, care are o structură anhidră.
De asemenea, este solubil în disulfură de carbon și alți solvenți organici.
LA caracteristicile elementului sulf este important să adăugați caracteristicile sale chimice. Ea este activă în acest sens. Dacă sulful este încălzit, se poate combina pur și simplu cu aproape orice element chimic.

Fotografia prezintă o mostră de sulf extras în Uzbekistan
Cu excepția gazelor inerte. La contactul cu metale, substanțe chimice. elementul formează sulfuri. Temperatura camerei permite elementului să reacționeze cu. Creșterea temperaturii crește activitatea sulfului.
Să luăm în considerare modul în care sulful se comportă cu substanțele individuale:
Cu metale este un agent oxidant. Formează sulfuri.
Interacțiunea activă are loc cu hidrogenul la temperaturi ridicate – până la 200 °C.
Cu oxigen. Oxizii se formează la temperaturi de până la 280 °C.
Cu fosfor, carbon – este un agent oxidant. Doar dacă nu există aer în timpul reacției.
Cu fluor acționează ca un agent reducător.
Cu substanțe care au o structură complexă - și ca agent reducător.
Zacaminte si productie de sulf
Principala sursă de obținere a sulfului sunt depozitele acestuia. În total, există 1,4 miliarde de tone de rezerve din această substanță la nivel mondial. Este exploatat atât prin minerit deschis și subteran, cât și prin topire din subteran.

Fotografia arată exploatarea sulfului în vulcanul Kawa Ijen
Dacă se aplică ultimul caz, atunci se folosește apă, care este supraîncălzită și topește sulful cu ea. În minereurile de calitate scăzută, elementul este conținut în aproximativ 12%. Bogat – 25% și mai mult.
Tipuri comune de depozite:
Stratiform – până la 60%.
Domul de sare – până la 35%.
Vulcanogenă – până la 5%.
Primul tip este asociat cu straturi numite sulfat-carbonat. În același timp, corpurile de minereu care au o grosime de până la câteva zeci de metri și o dimensiune de până la sute de metri sunt situate în roci sulfatice.
De asemenea, aceste depozite de strat pot fi găsite printre rocile de origine sulfat și carbonat. Al doilea tip este caracterizat de depozite gri, care sunt limitate la cupole de sare.
Ultimul tip este asociat cu vulcanii care au o structură tânără și modernă. În acest caz, elementul minereu are o formă de lentilă, asemănătoare foii. Poate conține sulf în cantitate de 40%. Acest tip de depozit este comun în centura vulcanică a Pacificului.
Depozit de sulfîn Eurasia este situat în Turkmenistan, regiunea Volga și alte locuri. Roci de sulf se găsesc lângă malul stâng al Volgăi, care se întind din Samara. Lățimea fâșiei de stâncă ajunge la câțiva kilometri. Mai mult, ele pot fi găsite până la Kazan.

Fotografia arată sulful în rocă
În Texas și Louisiana, cantități uriașe de sulf se găsesc pe acoperișurile domurilor de sare. Italienii deosebit de frumoși ai acestui element se găsesc în Romagna și Sicilia. Și pe insula Vulcano găsesc sulf monoclinic. Elementul, care a fost oxidat de pirita, a fost găsit în Urali, în regiunea Chelyabinsk.
Pentru minerit element chimic sulf utilizați metode diferite. Totul depinde de condițiile apariției sale. În același timp, desigur, se acordă o atenție deosebită siguranței.
Deoarece hidrogenul sulfurat se acumulează împreună cu minereul de sulf, este necesar să se adopte o abordare deosebit de serioasă a oricărei metode de exploatare, deoarece acest gaz este otrăvitor pentru oameni. De asemenea, sulful tinde să se aprindă.
Cel mai adesea folosesc metoda deschisă. Deci, cu ajutorul excavatoarelor, părți semnificative din roci sunt îndepărtate. Apoi partea de minereu este zdrobită folosind explozii. Bucățile sunt trimise la fabrică pentru îmbogățire. Apoi - la instalația de topire a sulfului, unde sulful se obține din concentrat.

Fotografia arată sulful în port, adus pe mare
În cazul apariției în adâncime a sulfului în multe volume, se utilizează metoda Frasch. Sulful se topește încă în subteran. Apoi, ca și uleiul, este pompat printr-un puț spart. Această abordare se bazează pe faptul că elementul se topește ușor și are o densitate scăzută.
De asemenea, este cunoscută o metodă de separare prin centrifuge. Doar această metodă are un dezavantaj: sulful se obține cu impurități. Și apoi este necesar să se efectueze o curățare suplimentară.
În unele cazuri, se utilizează metoda forajului. Alte posibilități de extragere a elementului sulf:
Abur-apă.
Filtrare.
Termic.
Centrifugal.
Extracţie.
Aplicarea sulfului
Majoritatea sulfului extras este folosit pentru a produce acid sulfuric. Și rolul acestei substanțe este foarte mare în producția chimică. Este de remarcat faptul că pentru a obține 1 tonă de substanță sulfurică este nevoie de 300 kg de sulf.
Sparklers, care strălucesc puternic și au mulți coloranți, sunt, de asemenea, făcute folosind sulf. Industria hârtiei este un alt domeniu în care merge o parte semnificativă a substanței extrase.

În imagine este un unguent cu sulf
Mai des aplicarea de sulf găsește atunci când satisface nevoile de producție. Aici sunt câțiva dintre ei:
Utilizare în producția chimică.
Pentru producerea de sulfiți, sulfați.
Producția de substanțe pentru fertilizarea plantelor.
Pentru a obține tipuri de metale neferoase.
Pentru a conferi oțelului proprietăți suplimentare.
Pentru confectionarea chibritelor, materialelor pentru explozii si pirotehnica.
Vopselele și fibrele din materiale artificiale sunt produse folosind acest element.
Pentru albirea țesăturilor.
In unele cazuri element sulf incluse în unguente care tratează bolile de piele.
Pretul sulfului
Potrivit ultimelor știri, nevoia de sulf este în creștere activă. Costul unui produs rusesc este de 130 de dolari. Pentru versiunea canadiană – 145 USD. Dar în Orientul Mijlociu, prețurile au crescut la 8 USD, rezultând un cost de 149 USD.

Fotografia prezintă un specimen mare de sulf mineral
În farmacii puteți găsi pulbere de sulf măcinat la un preț de 10 până la 30 de ruble. În plus, este posibil să-l cumpărați în vrac. Unele organizații oferă să achiziționeze echipamente tehnice granulare la un preț mic. sulf gazos.
/ mineral Sulphur Native
Sulful nativ este un mineral comun din clasa elementelor native. Sulful este un exemplu de polimorfism enantiomorf bine definit. În natură formează 2 modificări polimorfe: sulf a-ortorombic și sulf b-monoclinic. La presiunea atmosferică și la o temperatură de 95,6°C, a-sulful se transformă în b-sulf. Soi: Vulcanit (sulf de seleniu). Culoare portocaliu-roșu, roșu-maro. Originea este vulcanică. Sulful nativ se caracterizează prin: un luciu nemetalic și faptul că sulful se aprinde cu un chibrit și arde cu o flacără albastră, eliberând dioxid de sulf, care are un miros ascuțit de sufocare. Cea mai caracteristică culoare a sulfului nativ este galben deschis. Ușor solubil în balsam de Canada, terebentină și kerosen. Insolubil în apă, dar solubil în CS2. Insolubil în HCI și H2SO4. HNO3 și acva regia oxidează sulful, transformându-l în H2SO4. Sulful se formează în timpul erupțiilor vulcanice, în timpul intemperii a sulfurilor, în timpul descompunerii straturilor sedimentare purtătoare de gips și, de asemenea, în legătură cu activitatea bacteriilor. Principalele tipuri de zăcăminte de sulf nativ sunt vulcanogene și exogene (chemogenic-sedimentare). Predomină depozitele exogene; sunt asociate cu anhidrite de gips, care, sub influența emisiilor de hidrocarburi și hidrogen sulfurat, sunt reduse și înlocuite cu minereuri de sulf-calcit. Toate depozitele majore au o astfel de geneză infiltrativă-metasomatică. Sulful nativ se formează adesea (cu excepția acumulărilor mari) ca urmare a oxidării H2S. Procesele geochimice ale formării sale sunt activate semnificativ de microorganisme (bacteriile sulfato-reducătoare și tionice). Dintre zăcămintele vulcanogene de sulf nativ, principalele sunt hidrotermo-metasomatice (de exemplu, în Japonia), formate din cuarțite și opalite purtătoare de sulf, și nămoluri vulcanogene-sedimentare purtătoare de sulf ale lacurilor de cratere. De asemenea, se formează în timpul activității fumarolelor. Format în condițiile suprafeței pământului, sulful nativ nu este încă foarte stabil și, oxidându-se treptat, dă naștere la sulfați, cap. ca tencuiala. Uneori, în timpul proceselor vulcanice, sulful este ejectat sub formă lichidă. Acest lucru se întâmplă atunci când sulful, depus anterior pe pereții craterelor, se topește pe măsură ce temperatura crește. Sulful se depune și din soluții apoase fierbinți ca urmare a descompunerii hidrogenului sulfurat și a compușilor de sulf eliberați în timpul uneia dintre fazele ulterioare ale activității vulcanice. Aceste fenomene sunt acum observate în apropierea gheizerelor din Parcul Yellowstone (SUA) și Islanda. Se gaseste impreuna cu gips, anhidrita, calcar, dolomita, saruri de roca si potasiu, argile, depozite bituminoase (ulei, ozocherita, asfalt) si pirita. Se găsește și pe pereții craterelor vulcanice, în crăpăturile din lave și tuf care înconjoară gurile vulcanilor, atât activi, cât și dispăruți, lângă izvoarele minerale cu sulf. Pe teritoriul Eurasiei, toate zăcămintele industriale de sulf nativ sunt de origine superficială. Unele dintre ele sunt situate în Turkmenistan, în regiunea Volga etc. Roci care conțin sulf se întind de-a lungul malului stâng al Volgăi de la orașul Samara într-o fâșie de câțiva kilometri lățime până la Kazan. Sulful s-a format probabil în lagune în perioada Permiană ca urmare a proceselor biochimice. Zăcămintele de sulf sunt situate în Razdol (regiunea Lviv, regiunea Carpaților), Yavorovsk (Ucraina) și în regiunea Ural-Embinsky. În Urali (regiunea Chelyabinsk) se găsește sulf, format ca urmare a oxidării piritei. Sulful de origine vulcanică se găsește în Kamchatka și Insulele Kuril. Principalele rezerve de sulf ale țărilor capitaliste se află în Irak, SUA (Louisiana și Utah), Mexic, Chile, Japonia și Italia (Sicilia). sulf sedimentar biogen: Sulf de origine vulcanică: Sulf în zonele de oxidare a sulfurilor: Folosit la producerea acidului sulfuric (aproximativ 50% din cantitatea extrasă). În 1890, Hermann Frasch a propus topirea sulfului în subteran și extragerea lui la suprafață prin puțuri, iar în prezent zăcămintele de sulf sunt dezvoltate în principal prin topirea sulfului nativ din straturile subterane direct la locul său. Sulful se găsește și în cantități mari în gazele naturale (sub formă de hidrogen sulfurat și dioxid de sulf); în timpul producției de gaz, se depune pe pereții conductelor, făcându-le inoperabile, astfel încât este recuperat din gaz cât mai repede posibil. după producție. Sulful este utilizat pe scară largă în industria chimică, a celulozei și a hârtiei (producția de sulfat de celuloză), în industria pielii și a cauciucului (vulcanizarea cauciucului) și în agricultură (producția de pesticide).
Sulful nativ este de obicei reprezentat de a-sulf. Sulful, spre deosebire de alte elemente native, are o rețea moleculară, ceea ce determină duritatea sa scăzută.Caracteristici
Locul nașterii
Aplicație
raportați o eroare în descriere
Proprietățile mineralului
| Culoare | Sulful pur este galben deschis, cu impurități de seleniu - maro închis, arsenic - roșu aprins, bitum - maro închis și negru. Sulful alb lăptos și albastru este cunoscut. |
| Culoarea tractului | Galben pai, alb |
| originea numelui | Cuvântul „sulf”, cunoscut în limba rusă veche încă din secolul al XV-lea, este împrumutat din „sera” slavonă veche - „sulf, rășină”, în general „substanță inflamabilă, grăsime”. Etimologia cuvântului nu a fost clarificată până în prezent, deoarece denumirea slavă comună originală pentru substanță a fost pierdută și cuvântul a ajuns în limba rusă modernă într-o formă distorsionată. Potrivit lui Vasmer, „sulful” se întoarce la lat. sera - „ceară” sau lat. ser - „ser”. Sulphul latin (derivat din ortografia elenizată a etimologicului sulpur) se presupune că se întoarce la rădăcina indo-europeană *swelp - „a arde” |
| Anul deschiderii | cunoscut din cele mai vechi timpuri |
| Statutul IMA | valabil, descris pentru prima dată înainte de 1959 (înainte de IMA) |
| Formula chimica | S8 |
| Strălucire | gras răşină |
| Transparenţă | transparent translucid |
| Clivaj | imperfect de (001) imperfect de (110) imperfect de (111) |
| Kink | concoidal neuniformă |
| Duritate | 2 |
| Proprietati termice | Sulful are un punct de topire scăzut - 113°C. Arde cu ușurință în aer, arde cu o flacără albastră, eliberând vapori sufocatori de dioxid de sulf (care, atunci când interacționează cu apa, formează acid sulfuric, care cade sub formă de precipitații pe sol). |
| Impurități tipice | Se,Te |
| Strunz (ediția a 8-a) | 1/0.0-10 |
| Hei's CIM Ref. | 1.51 |
| Dana (ediția a 7-a) | 1.3.4.1 |
| Dana (ediția a 8-a) | 1.3.5.1 |
| Opțiuni pentru celule | a = 10,468 Å, b = 12,870 Å, c = 24,49 Å |
| Atitudine | a:b:c = 0,813:1:1,903 |
| Numărul de unități de formulă (Z) | 128 |
| Volumul unitar al celulei | V 3.299,37 Å |
| Înfrățirea | Gemenii la (101), (011), (110) sunt destul de rari. |
| Grup de puncte | mmm (2/m 2/m 2/m) - Dipiramidal |
| Grup spațial | Fddd (F2/d 2/d 2/d) |
| Separarea | separate prin (111) |
| Densitate (calculată) | 2.076 |
| Densitate (măsurată) | 2.07 |
| Pleocroismul | vizibil |
| Dispersia axei optice | r relativ slab |
| Indici de refracție | nα = 1,958 nβ = 2,038 nγ = 2,245 |
| Birefringenta maxima | 5 = 0,287 |
| Tip | biaxial (+) |
| unghi 2V | măsurată: 68°, calculată: 70° |
| Relief optic | foarte inalt |
| Formular de selecție | Formează cristale trunchi-bipiramidale, mai rar bipiramidale, pinacoidale sau prismatice groase, precum și agregate criptocristaline dense, confluente, granulare și mai rar fibroase fine. Principalele forme în cristale: dipiramide (111) și (113), prisme (011) și (101), pinacoid (001). De asemenea, intercreșteri și druse de cristale, cristale scheletice, pseudostalactite, mase pulverulente și pământoase, depozite și adezivi. Cristalele sunt caracterizate de multiple intercreșteri paralele. |
| Cursuri de taxonomie a URSS | Nemetale |
| cursuri IMA | Elemente native |
| singhia | rombic |
| Fragilitate | da |
| combustie | da |
| Literatură | Areis V.Zh. Dezvoltarea zăcămintelor de sulf nativ prin topire subterană. - M., 1973 Zăcăminte vulcanice de sulf și unele probleme de formare a minereului hidrotermal. - M., 1971 Geochimia și mineralogia sulfului, M., 1972 |
Catalog de minerale